Réaliser la synthèse d'une molécule (exemple de l'ester)
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
Connaitre les étapes de transformation des réactifs, d’isolement, de purification et d’analyse pour la synthèse d’un produit.
- La synthèse d’un produit nécessite l’utilisation d’un chauffage à reflux.
- On utilise un catalyseur pour accélérer la réaction.
- On procède ensuite à l’extraction et à la purification du produit pour le récupérer pur.
- On analyse enfin ce produit pour estimer sa pureté.
- Règles de sécurité au laboratoire
- Réaction chimique
- Extraction liquide-liquide
- Chauffage à reflux
- Chromatographie sur couche mince
- Distillation fractionnée
On utilise pour cela plusieurs réactifs sous forme solide, gazeuse ou liquide. Ces réactifs vont être consommés pour former le produit recherché.
Une réaction de synthèse se déroule en plusieurs étapes, du mélange des réactifs à l’obtention du produit final, purifié.
- Réaliser la transformation chimique grâce à un chauffage à reflux.
- Isoler le produit synthétisé.
- Purifier le produit synthétisé pour le débarrasser de toutes les impuretés.
- Analyser le produit synthétisé.
La réalisation d’une synthèse présente plusieurs enjeux importants.
- Utiliser des réactifs faciles à se procurer et peu couteux.
- Obtenir un rendement le plus élevé possible, ce qui inclut l’énergie investie (chauffage).
- Tenir compte de l’éventuelle nocivité/toxicité de certains réactifs, produits intermédiaires ou sous-produits de réaction.
- Prévoir l’extraction et la purification de la molécule à synthétiser.
On étudie une estérification qui consiste à synthétiser un ester. Cet exemple va nous permettre de présenter de manière générale les différentes étapes d’une synthèse.
La synthèse d’un ester consiste à faire réagir 2 réactifs :
- un alcool qui contient le groupe hydroxyle ;
- un acide carboxylique qui contient le groupe carboxyle.
On obtient alors une nouvelle molécule qui contient le groupe caractéristique ester.
Pour produire l’ester, il faut prélever les réactifs puis les mettre en contact afin qu’ils interagissent.
L’éthanoate de 3-méthylbutyle, nommé aussi acétate d'isoamyle, est un ester à l’odeur de banane. Pour le synthétiser, on fait réagir de l’acide éthanoïque (acide carboxylique) avec du 3-méthylbutan-1-ol (alcool).
L’équation de la réaction s’écrit de la manière suivante.
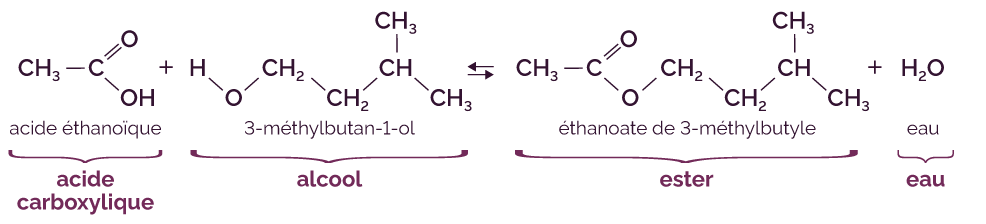
Réaction chimique de la synthèse de l’ester
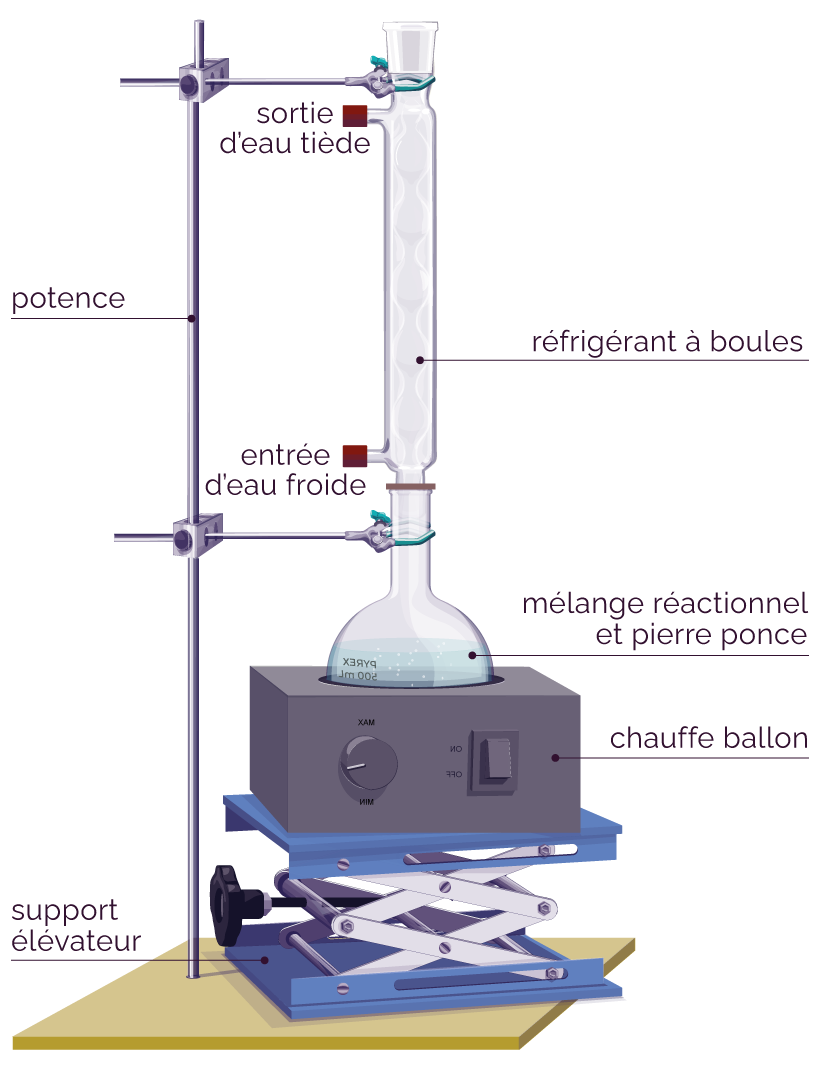
Montage du chauffage à reflux
Le chauffage étant soutenu, on utilise un réfrigérant efficace, c'est-à-dire un réfrigérant à boules, afin de refroidir suffisamment les vapeurs pour éviter qu’elles ne s’échappent.
- Le support élévateur permet de désolidariser le ballon et le chauffe-ballon en cas de besoin, afin de stopper rapidement le chauffage du milieu réactionnel, par exemple si l’ébullition devient trop forte.
- L’ajout de pierre ponce dans le ballon favorise la formation de bulles, et donc l’ébullition. Une ébullition se fait à température constante, cela permet donc un chauffage homogène du milieu réactionnel.
Accélérer la réaction
Cette réaction d’estérification est lente et limitée. Pour l’accélérer, on peut chauffer le milieu réactionnel, la température étant un facteur cinétique. Cela justifie l’emploi d’un montage de chauffage à reflux.
- La synthèse dure environ une demi-heure.
- Un facteur cinétique est un paramètre physique qui permet d’influer sur la vitesse d'une transformation chimique.
On peut également utiliser l’ion oxonium
![]() qui est un catalyseur de
cette réaction.
qui est un catalyseur de
cette réaction.
Se protéger
Les acides utilisés sont corrosifs, ce qui exige de prendre des précautions lors de leur manipulation.
L’alcool utilisé est quant à lui inflammable, nocif et irritant pour les voies respiratoires.
À la fin du chauffage, le milieu
réactionnel contient les réactifs et
produits de la réaction, ainsi que le
catalyseur.
Lorsque tous les réactifs et produits de la
réaction sont sous forme liquide, pour extraire
l’ester, on réalise une extraction
liquide-liquide, dans une ampoule à
décanter.
L’ajout de chlorure de sodium (eau salée) favorise la migration de l’ester de la phase aqueuse vers la phase organique. L’ester est en effet très peu soluble dans l’eau salée.
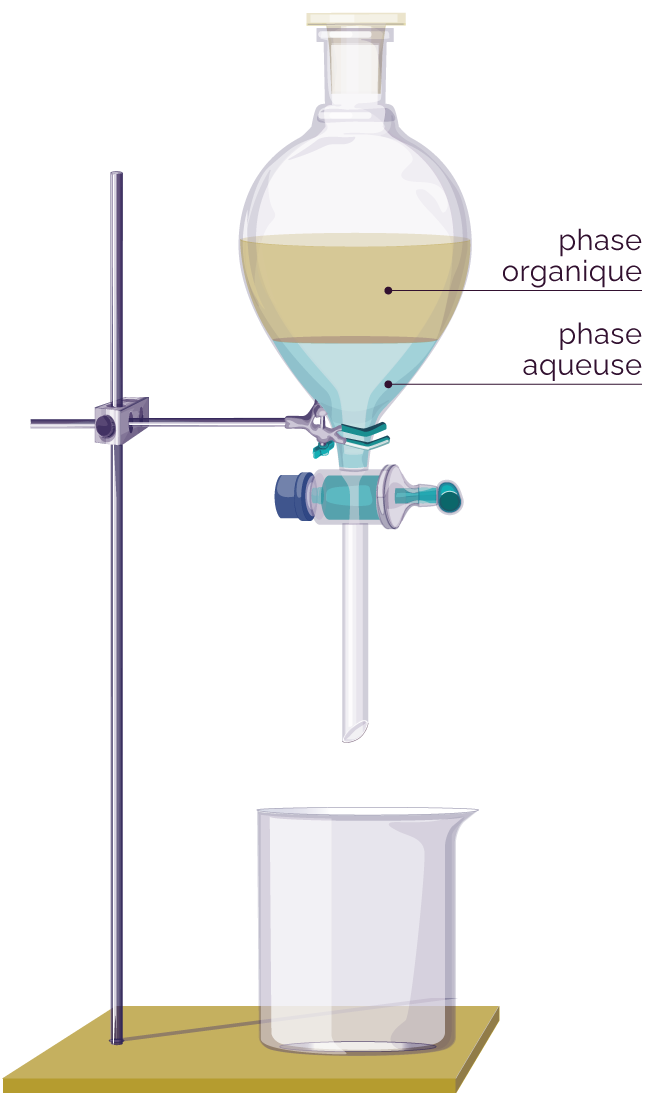
Ampoule à décanter
Il se forme deux phases :
- une phase aqueuse qui contient de l’eau, des acides et des traces d’ester et d’alcool ;
- une phase organique qui contient principalement l’ester, l’alcool et des traces d’acides et d’eau.
La masse volumique de l’ester est de 0,87 kg/L et la masse volumique de l’eau est de 1,00 kg/L. Cela explique que la phase organique soit située au-dessus de la phase aqueuse.
Lorsque le produit à récupérer est sous forme solide, on réalise une filtration pour l’isoler du reste du milieu réactionnel qui est liquide.
L’ester obtenu n’est pas pur. Il reste des traces d’impuretés dont il faut se débarrasser. On procède alors à sa purification qui consiste à le séparer de toutes les traces du milieu réactionnel.
Après élimination de la phase aqueuse, on
verse de l’hydrogénocarbonate de sodium
![]() en excès pour consommer
entièrement les acides.
en excès pour consommer
entièrement les acides.
En solution, l’ion hydrogénocarbonate
![]() formé agit en tant
que base et réagit avec l’acide
éthanoïque et l’ion oxonium
formé agit en tant
que base et réagit avec l’acide
éthanoïque et l’ion oxonium ![]() .
.
L’ajout d’un déshydratant comme le sulfate de magnésium anhydre permet de nettoyer la phase organique des traces d’eau restantes. La phase organique contient alors l’ester produit et des traces de l’alcool.
On procède alors à une distillation fractionnée, qui consiste à chauffer le milieu réactionnel à l’aide d’un ballon surmonté d’une colonne de Vigreux. On récupère ainsi, par évaporation puis condensation, l’élément chimique de température d’ébullition la plus faible.
La distillation fractionnée permet donc de se débarrasser de cet alcool car sa température d’ébullition (132 °C) est légèrement plus faible que celle de l’ester (142 °C). On récupèrera l’alcool en premier.
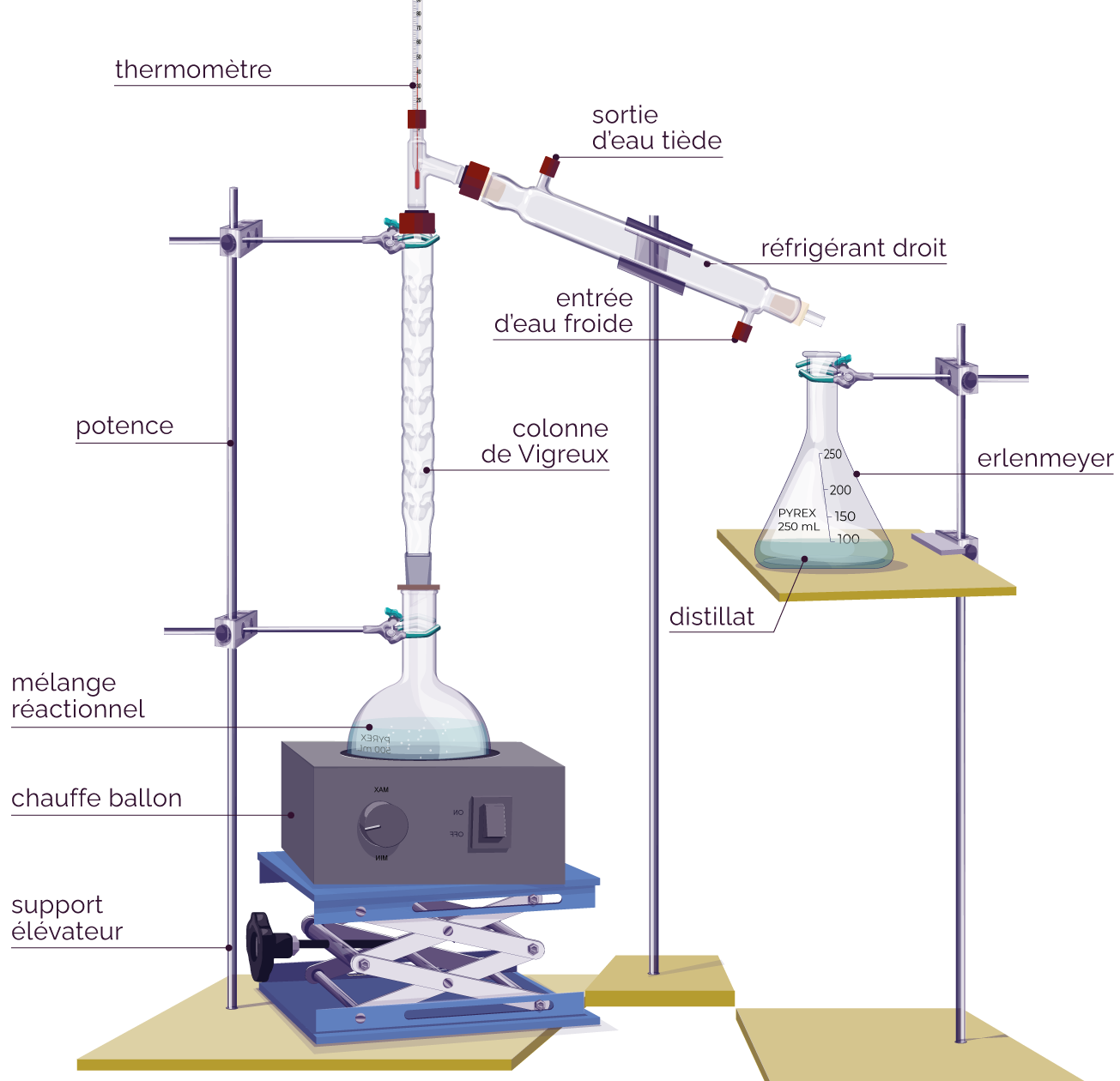
Schéma d'un montage de distillation fractionnée
Pour vérifier que l’ester produit est pur, on procède à une chromatographie sur couche mince (CCM). On est censé obtenir une seule tâche sur le chromatogramme lors de la migration des constituants.
Si le test est concluant, on calcule le rendement de la synthèse.
Le rendement d’une réaction chimique nous renseigne sur la productivité de cette réaction.
Il se note η et s’exprime par la relation suivante.
|
|
avec :
|

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








