Établir le schéma de Lewis d'un ion
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
- Établir le schéma de Lewis d’un ion monoatomique ou polyatomique.
- Comprendre la notion de lacune électronique.
- Les atomes perdent ou gagnent des électrons de leur couche de valence afin d’avoir la structure électronique stable des gaz nobles : ils deviennent des ions monoatomiques.
- Les ions monoatomiques possèdent soit un doublet non liant (duet), soit quatre doublets non liants (octet). Dans le cas de l’ion hydrogène H+, il y a une lacune électronique (il manque deux électrons sur la couche externe).
- Le schéma de Lewis des atomes permet de trouver le schéma de Lewis d’un ion polyatomique, par application de la règle du duet ou de l’octet.
- Les règles du duet et de l’octet
- Composition et neutralité d’un atome
- La structure électronique d’un atome
- Le schéma de Lewis d’un atome et d’une molécule
La grande stabilité des atomes de gaz nobles est expliquée par leur configuration électronique particulière.
La configuration électronique de 3 gaz nobles est donnée dans le tableau ci-dessous.
| Nom | Hélium | Néon | Argon |
| Symbole | He | Ne | Ar |
| Configuration électronique | 1s2 | 1s2 2s2 2p6 | 1s2 2s2 2p6 3s2 3p6 |
| Nombre d’électrons dans l’atome | 2 | 10 | 18 |
La couche de valence n de l’atome d’hélium (n = 1) possède deux électrons de valence (duet) tandis que les couches de valence des atomes de néon (n = 2) et d’argon (n = 3) possèdent huit électrons de valence (octet).
La couche de valence correspond à la dernière couche électronique n qui contient des électrons.
Les atomes perdent ou gagnent des électrons de valence de manière à ce que l’ion monoatomique obtenu ait la même configuration électronique que celle des gaz nobles, c’est-à-dire une configuration électronique de valence en duet (telle que celle de l’hélium) ou en octet (telle que celles du néon ou de l’argon).
Les atomes perdent ou gagnent des électrons de manière à obtenir la configuration électronique du gaz noble le plus proche dans la classification périodique des éléments.
On donne ci-dessous quelques exemples pour comprendre le lien entre la position d’un atome dans la classification et l’ion formé.
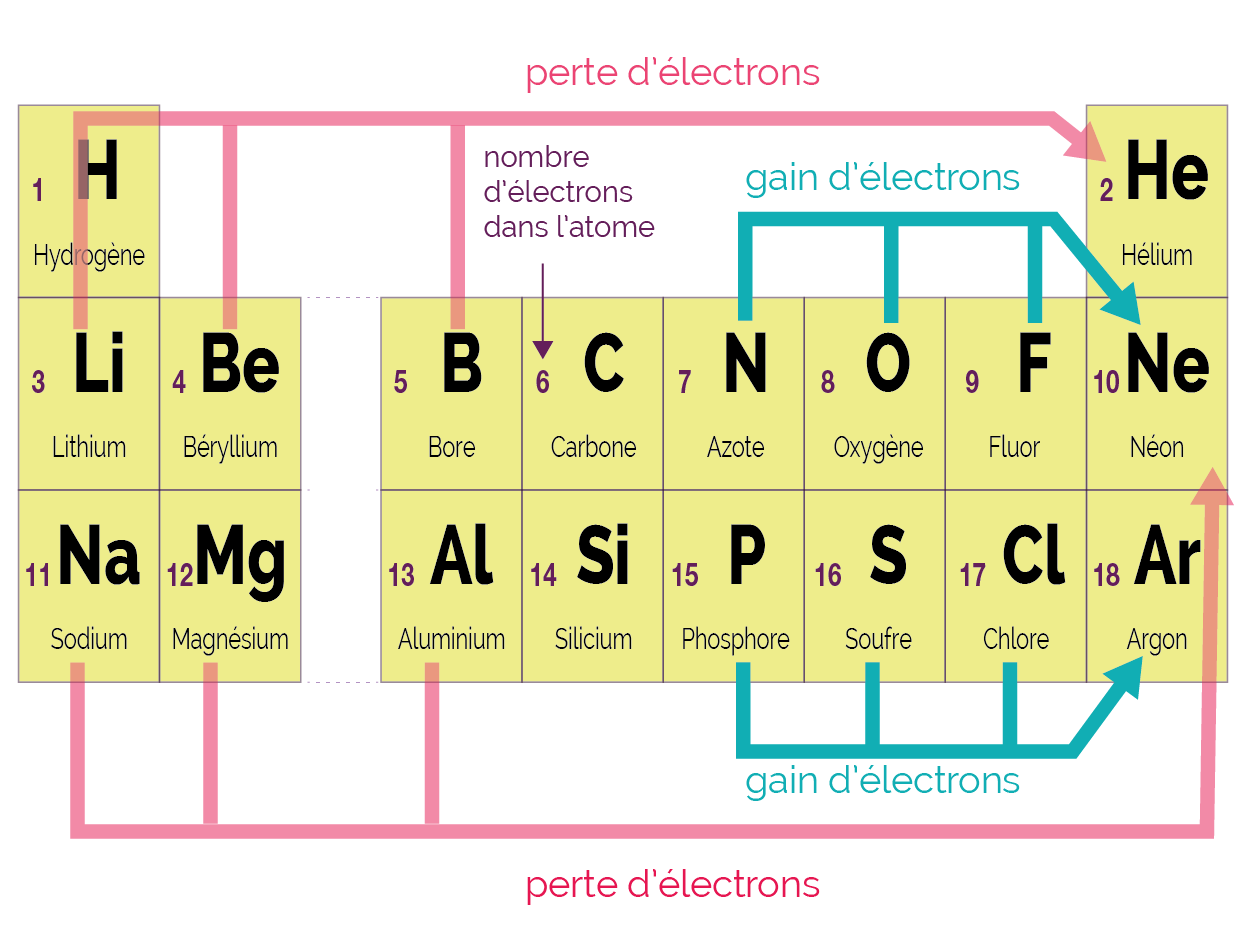
Classification périodique des éléments
- L’atome d’azote (de configuration électronique 1s2 2s2 2p3) gagne 3 électrons et se transforme en ion nitrure N3−, qui possède la configuration électronique en octet du néon (1s2 2s2 2p6).
- L’atome de chlore (de configuration électronique 1s2 2s2 2p6 3s2 3p5) gagne 1 électron et se transforme en ion chlorure Cl−, qui possède la configuration électronique en octet de l’argon (1s2 2s2 2p6 3s2 3p6).
- L’atome de magnésium (de configuration électronique 1s2 2s2 2p6 3s2) perd 2 électrons et se transforme en ion magnésium Mg2+, qui possède la configuration électronique en octet du néon (1s2 2s2 2p6).
- L’atome de lithium (de configuration électronique 1s2 2s1) perd 1 électron et se transforme en ion lithium Li+, qui possède la configuration électronique en duet de l’hélium (1s2).
Les atomes de carbone et de silicium ne forment pas d’ions monoatomiques car la perte ou le gain de 4 électrons ne se fait pas.
L’atome d’hydrogène (de configuration électronique 1s1) peut :
- soit gagner 1 électron et se transformer en ion hydrure H− (configuration électronique en duet de l’hélium : 1s2) ;
- soit perdre 1 électron et se transformer en ion hydrogène H+ (pas d’électron sur la couche de valence : 1s0).
Les ions monoatomiques possèdent tous une configuration électronique en duet ou en octet. Ils possèdent donc sur leur couche électronique de valence 2 ou 8 électrons, ce qui correspond à 1 ou 4 doublets électroniques (paquets de deux électrons).
Ces doublets sont représentés par des tirets placés à côté du symbole de l’atome.
Le tableau suivant donne le schéma de Lewis de quelques ions monoatomiques.
| Ion | nitrure | chlorure | lithium | magnésium | hydrure | hydrogène |
| Formule | N3− | Cl− | Li+ | Mg2+ | H− | H+ |
|
Schéma de Lewis |
|
|
|
|
|
|
L’ion hydrogène H+ possède une lacune électronique représentée par un rectangle.
Dans un ion polyatomique, les atomes réalisent des liaisons chimiques en mettant chacun en commun 1 électron de leur couche électronique de valence.
Par ce partage d’électrons, ils obtiennent une configuration électronique de valence en duet ou en octet. Les atomes possèdent alors sur leur couche électronique de valence deux types de doublets électroniques (paquet de deux électrons) : les doublets liants des liaisons chimiques et les doublets non liants qui appartiennent uniquement à l’atome.
- Le noyau et les couches électroniques internes sont représentés par le symbole de l’élément.
- Les électrons de la couche externe sont représentés par un point (•) s’ils sont célibataires ou par un tiret (—) s’ils forment un doublet non liant.
Le tableau suivant donne le schéma de Lewis de quelques atomes.
| Atome |
Nombre
d’électrons célibataires |
Nombre de doublets non liants |
Schéma de Lewis |
| Hydrogène | 1 | 0 |
|
| Carbone | 4 | 0 |
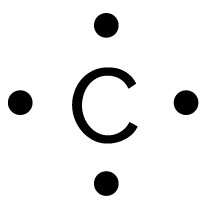
|
| Azote | 3 | 1 |

|
| Oxygène | 2 | 2 |
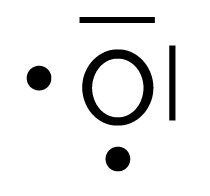
|
| Chlore | 1 | 3 |
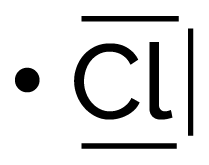
|
Dans un ion polyatomique, les atomes possèdent tous une configuration électronique en duet ou en octet. Ils ont donc sur leur couche électronique de valence 2 ou 8 électrons, ce qui correspond à 1 ou 4 doublets électroniques (paquets de deux électrons).
Ces doublets sont représentés par des tirets placés à côté du symbole de l’atome s’il s’agit de doublets non liants et des tirets entre les symboles des atomes s’il s’agit de doublets liants.
Les deux électrons célibataires mis en commun constituent alors le doublet liant entre les deux atomes.
La formation de l’ion hydroxyde OH− est représentée par le schéma ci-dessous.
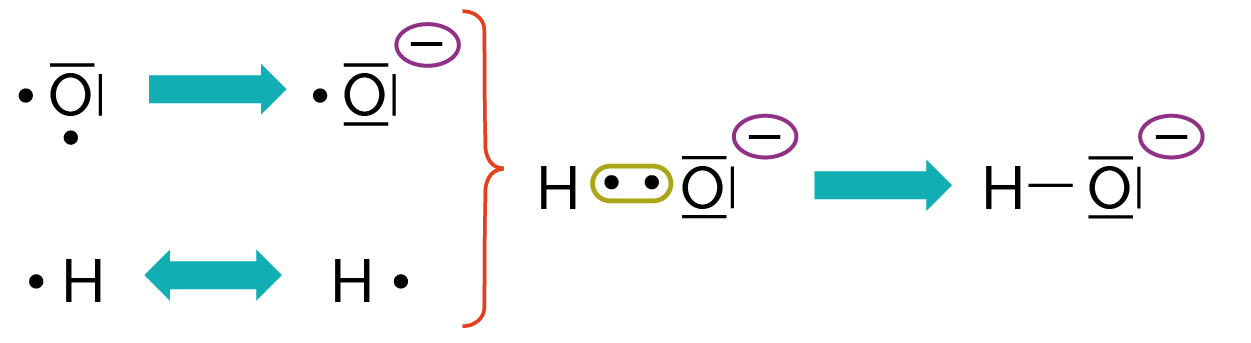
Les deux électrons du doublet non liant mis en commun constituent alors le doublet liant entre les deux atomes.
La formation de l’ion ammonium NH4+ est représentée par le schéma ci-dessous.
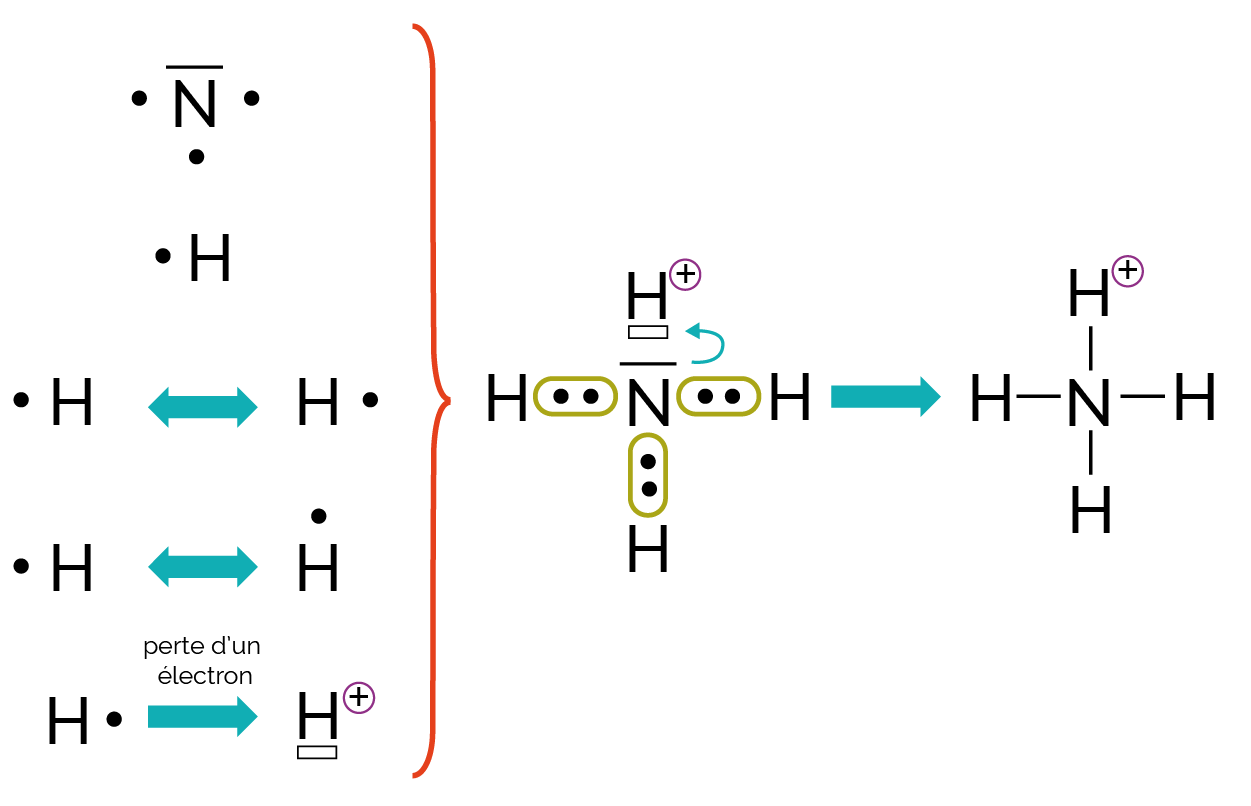
Une liaison de covalence correspond à la mise en commun d’un électron par chaque atome. Ces liaisons et les liaisons de coordinence sont en tout point identiques une fois réalisées.

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








