Des édifices ordonnés : les cristaux
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
- Utiliser une représentation 3D informatisée du cristal de chlorure de sodium. Relier l’organisation de la maille au niveau microscopique à la structure du cristal au niveau macroscopique.
- Pour chacun des deux réseaux (cubique simple et
cubique à faces centrées) :
- représenter la maille en perspective cavalière ;
- calculer la compacité dans le cas d’entités chimiques sphériques tangentes ;
- dénombrer les atomes par maille et calculer la masse volumique du cristal.
- Distinguer, en termes d’échelle et d’organisation spatiale, maille, cristal, minéral, roche. Les identifier sur un échantillon ou une image.
- Le chlorure de sodium solide (présent dans les roches ou issu de l’évaporation de l’eau de mer) est constitué d’un empilement régulier d’ions : c’est l’état cristallin.
- Une structure cristalline est définie par une maille élémentaire répétée périodiquement. Un type cristallin est défini par la forme géométrique de la maille, la nature et la position dans cette maille des entités qui le constituent.
- Les cristaux les plus simples peuvent être décrits par une maille cubique que la géométrie du cube permet de caractériser. La position des entités dans cette maille distingue les réseaux cubique simple et cubique à faces centrées.
- La structure microscopique du cristal conditionne certaines de ses propriétés macroscopiques dont sa masse volumique.
- Entité chimique, roche et minéral
- Géométrie du cube et de la sphère, calculs de volumes, proportions
À la différence des liquides et des gaz, les solides sont des systèmes ayant une forme propre. À l’échelle microscopique, les particules constituant le solide restent fixes les unes par rapport aux autres.
En fonction de l’organisation des particules composant le solide à l’échelle microscopique, on distingue deux types de solide.
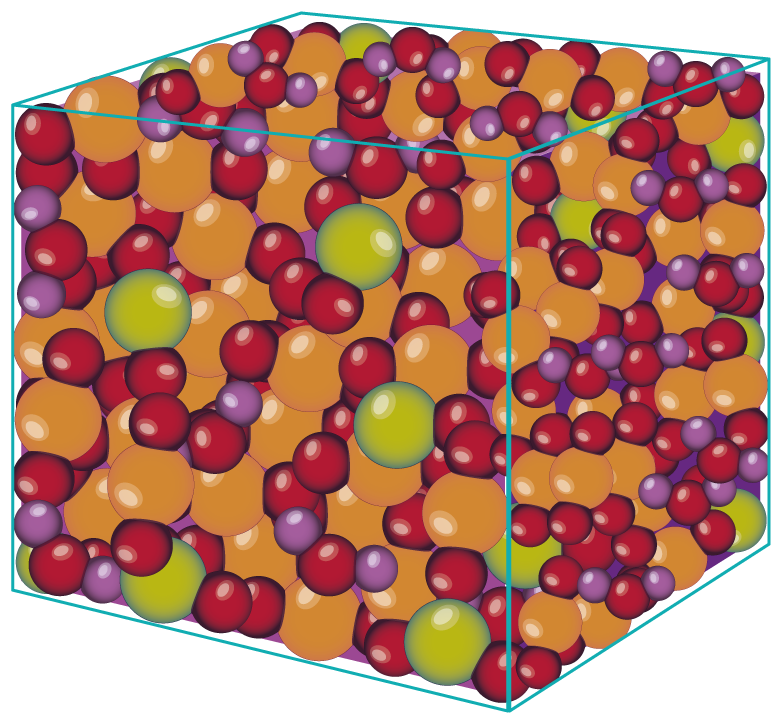
Arrangement à l’échelle microscopique d’un verre
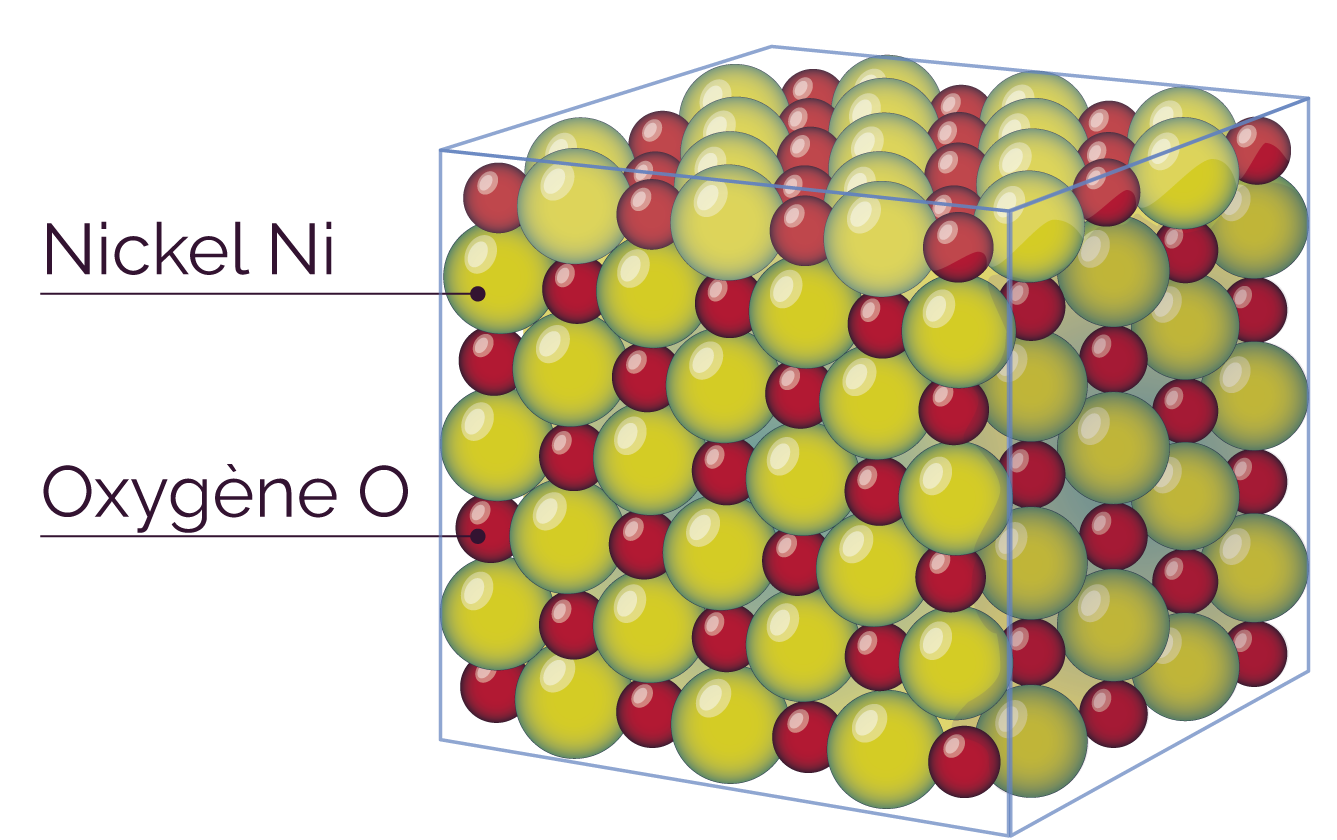
Arrangement à l’échelle microscopique d’un cristal d’oxyde de nickel NiO
Le chlorure de sodium solide est présent dans certaines roches et on peut le récupérer par évaporation de l’eau de mer. Il s’agit d’un empilement régulier d’ions sodium Na+ et d’ions chlorure Cl–.
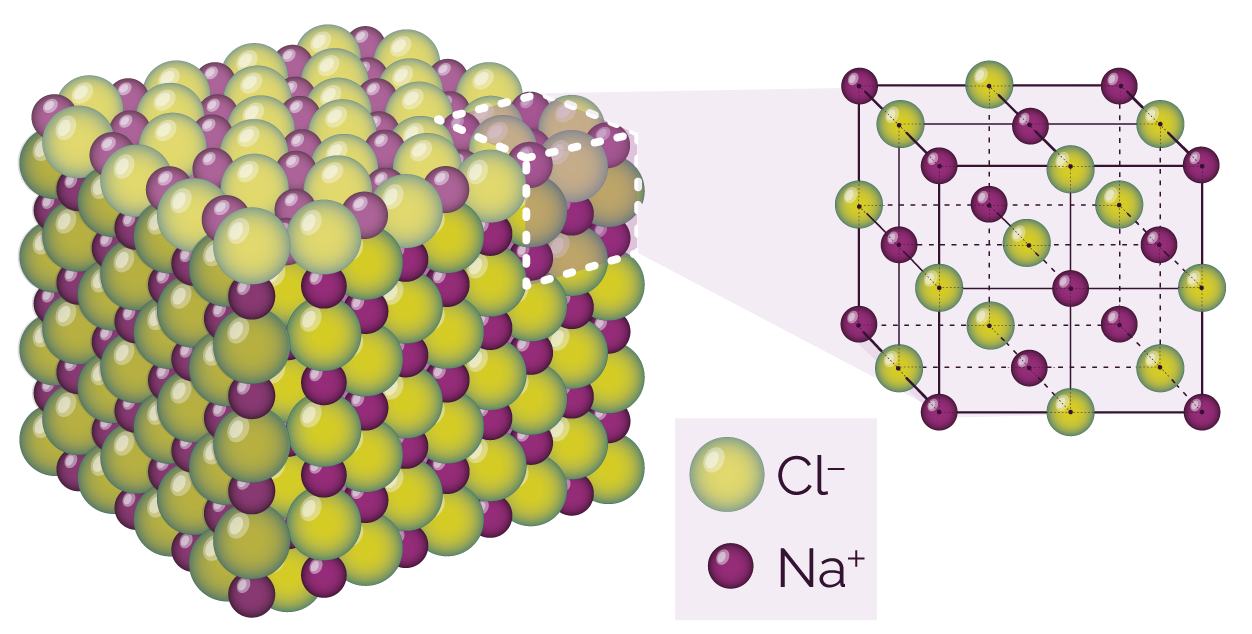
Représentation 3D de la maille élémentaire de chlorure de sodium
Cette maille élémentaire permet d’expliquer la structure à notre échelle du cristal (niveau macroscopique) qui est un empilement de cubes de chlorure de sodium.
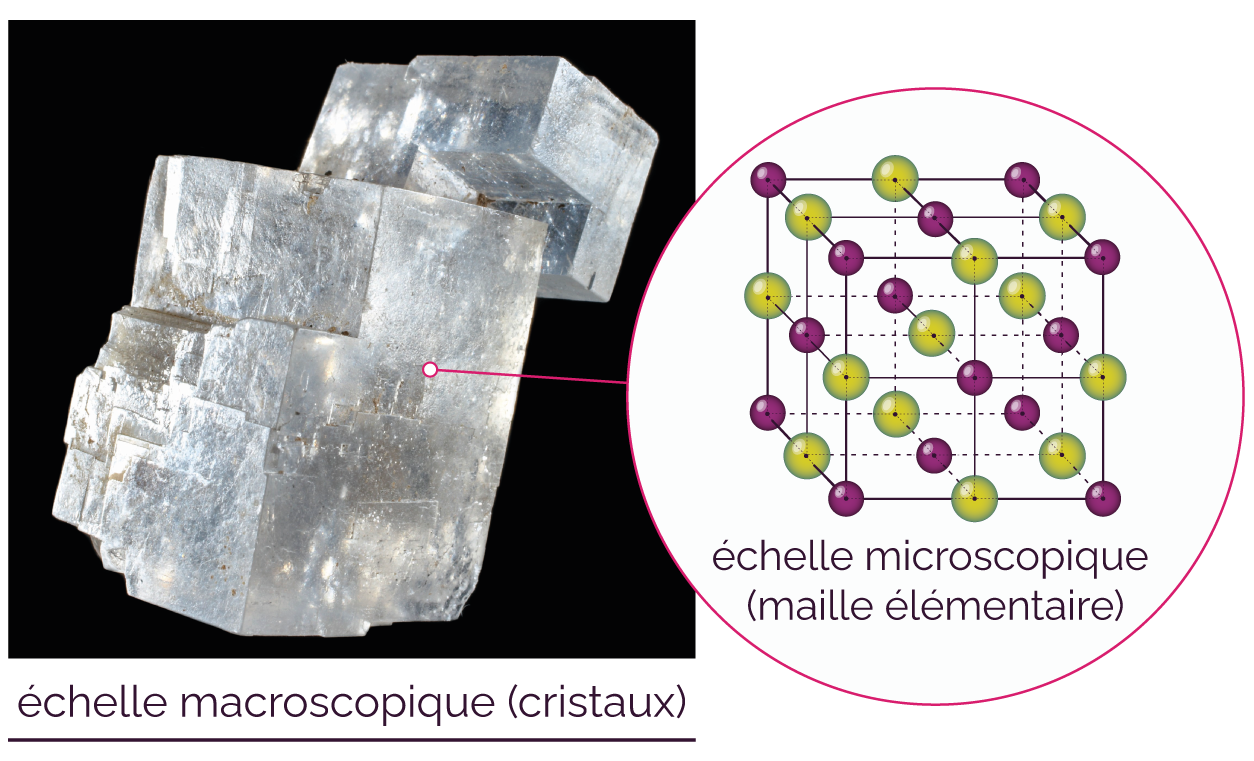
Photo de cristaux de chlorure de sodium et maille élémentaire du cristal

La calcite : de la formule chimique à la roche
Une roche magmatique se forme à partir du refroidissement d’une lave (roche en fusion). La structure, amorphe ou cristalline, d’une roche magmatique dépend de l’évolution de la température pendant le refroidissement.
-
1er cas : la
température se stabilise pendant le
refroidissement.
Dans ce cas, les entités chimiques ont le temps de se réorganiser et on obtient au final un solide avec une structure cristalline.
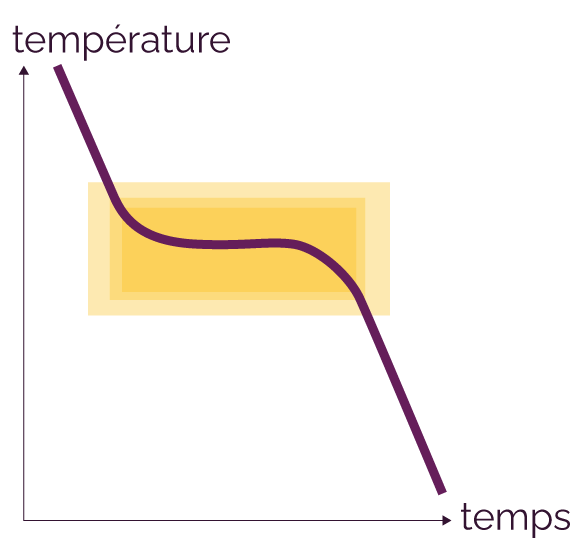
Évolution de la température au cours du refroidissement d’une lave -
2e cas : la température
diminue en permanence pendant le refroidissement.
Dans ce cas, les entités chimiques n’ont pas le temps de se réorganiser et on obtient un solide amorphe.
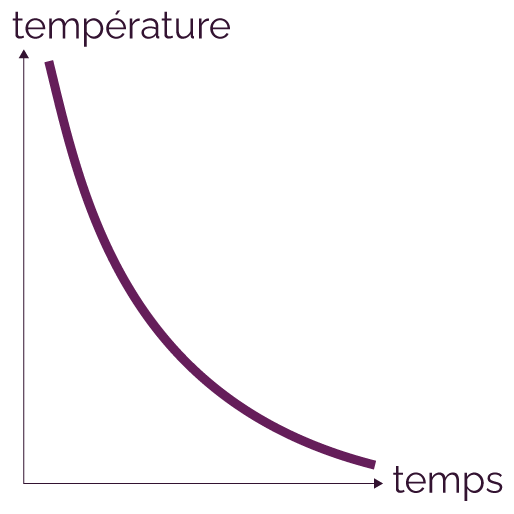
Évolution de la température au cours du refroidissement d’une lave
Les réseaux cristallins, en fonction de l’organisation de leurs atomes dans la maille élémentaire, se répartissent en différentes familles. Deux familles dont la maille élémentaire est un cube sont à connaitre.
- Un cube possède 6 faces, 8 sommets
et 12 arêtes.
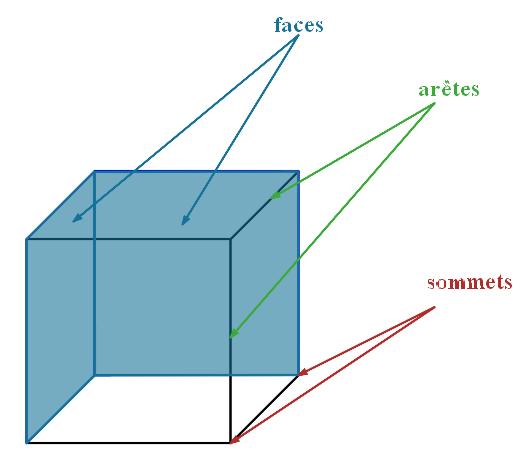
Visualisation d’une face, d’un sommet et d’une arête d’un cube - Un cube est caractérisé par la
longueur de ses arêtes qui
valent a. Son
volume V est alors égal
à : V = a3.
La longueur de l’arête est exprimée en mètre (m) et le volume en mètre cube (m3).
On peut aussi utiliser des sous-multiples du mètre :
- le centimètre : 1 cm = 1 × 10–2 m soit 1 cm3 = 1 × 10–6 m3 ;
- le millimètre : 1 mm = 1 × 10–3 m soit 1 mm3 = 1 × 10–9 m3 ;
- le micromètre : 1 μm = 1 × 10–6 m soit 1 μm3 = 1 × 10–18 m3 ;
- le nanomètre : 1 nm = 1 × 10–9 m soit 1 nm3 = 1 × 10–27 m3.
Dans la maille élémentaire d’un réseau cubique simple, on trouve un atome sur chaque sommet du cube (et aucun atome à l’intérieur du cube).
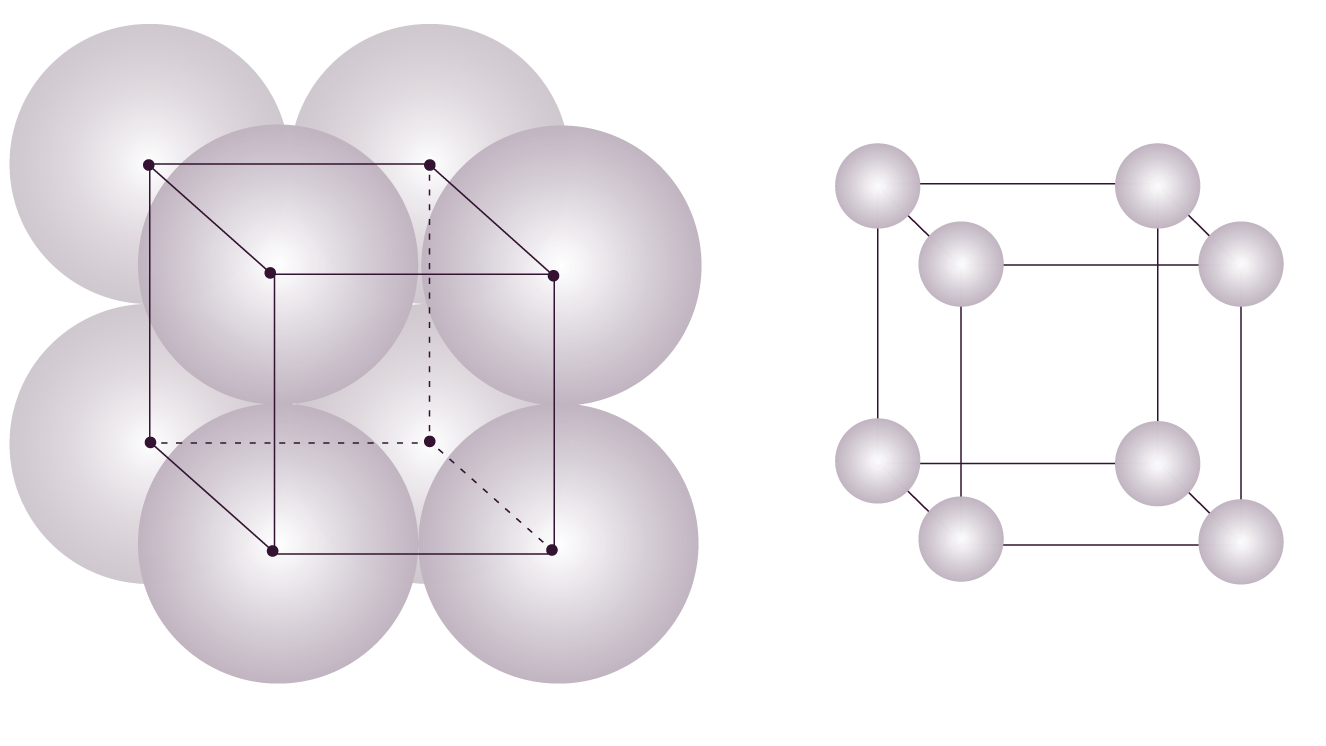
Maille cubique simple dans le modèle des sphères compactes tangentes
et dans le modèle éclaté
Les atomes présents dans une maille
n’appartiennent pas entièrement à
celle-ci car ils sont partagés avec
d’autres mailles. Ils comptent donc pour une
fraction dans la maille (![]() ). Dans le schéma
d’un réseau cubique simple ci-dessous, on
observe que chaque atome d’une maille se partage
entre 8 mailles en tout.
). Dans le schéma
d’un réseau cubique simple ci-dessous, on
observe que chaque atome d’une maille se partage
entre 8 mailles en tout.
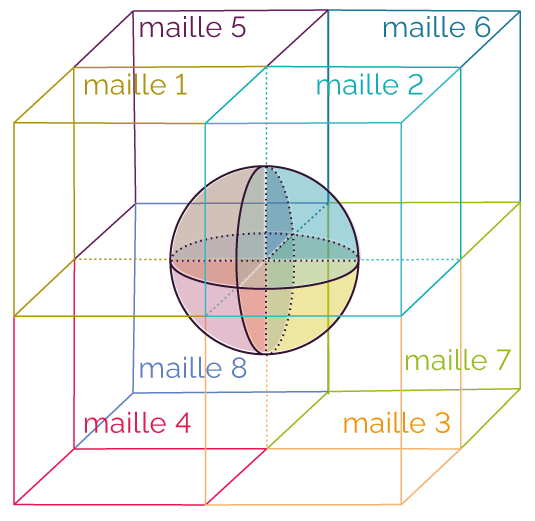
Dans un réseau cubique simple, 8 mailles se partagent un atome placé à un sommet.
Un atome situé au sommet d’une maille
compte donc pour ![]() de maille.
de maille.
Calculons le nombre d’atomes équivalents dans une maille :
- on compte 8 atomes, chacun placé à un sommet de la maille cubique ;
- chaque atome compte pour
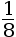 dans la maille ;
dans la maille ;
- le nombre N d’atomes
équivalents dans la maille est égal
à :
N = nombres d'atomes × fraction associée = 8 ×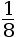 = 1.
= 1.
Dans la maille cubique simple, il y a donc un atome équivalent.
Dans la maille élémentaire d’un réseau cubique à faces centrées, on trouve un atome sur chaque sommet du cube et un atome au centre de chaque face :
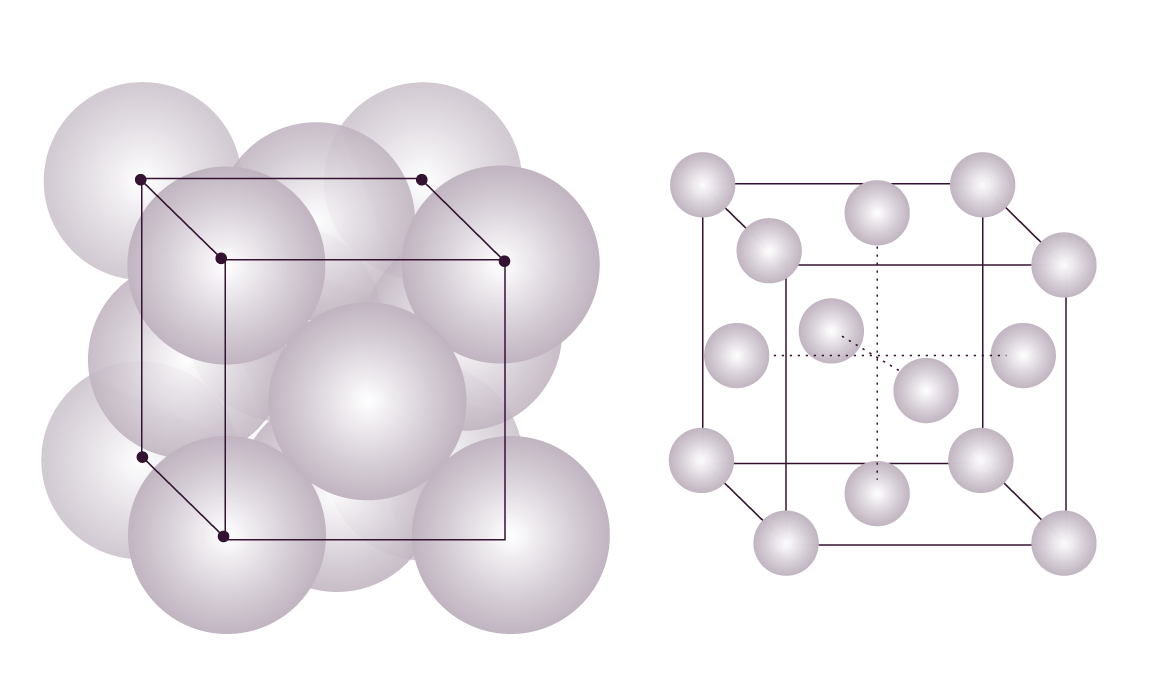
Maille cubique à faces centrées dans le modèle des sphères compactes tangentes
et dans le modèle éclaté
Chacun des atomes de la maille se partage avec les mailles adjacentes. Un atome situé à un sommet se partage entre 8 mailles (voir schéma précédent), tandis qu’un atome situé au centre d’une face se partage entre deux mailles.
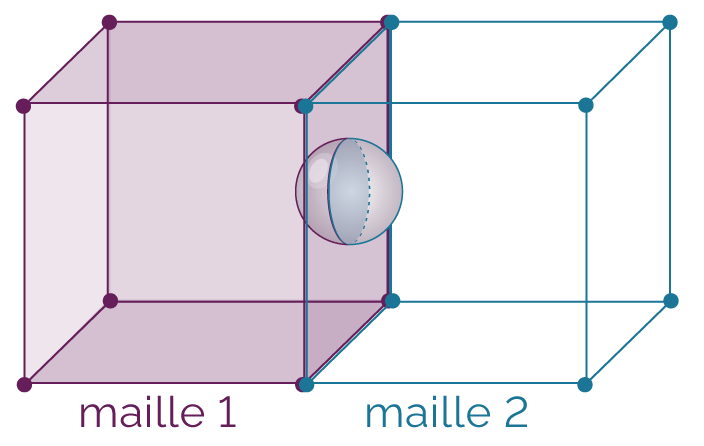
Dans un réseau cubique à faces centrées, deux mailles se partagent un atome
placé au centre d’une face.
Un atome situé au centre d’une face
d’une maille compte donc pour ![]() maille.
maille.
Calculons le nombre d’atomes équivalents
dans une maille :
- on compte 8 atomes, chacun placé à un sommet de la maille cubique ;
- chaque atome compte pour
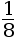 dans la maille ;
dans la maille ;
- on compte 6 atomes, chacun placé au centre d’une face de la maille cubique ;
- chaque atome compte pour
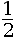 dans la maille ;
dans la maille ;
- le nombre N d’atomes
équivalents dans la maille est égal
à :
N = nombres d'atomes × fraction associée
N = 8 ×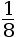 + 6 ×
+ 6 × 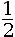 = 1 + 3 = 4.
= 1 + 3 = 4.
Dans la maille cubique à faces centrées, il y a donc quatre atomes équivalents.
Une maille est caractérisée par deux données qui sont la compacité et la masse volumique.
![]()
La valeur de la compacité est strictement comprise entre 0 (qui correspond à 0 %) et 1 (qui correspond à 100 %).
Une sphère est caractérisée par son rayon r. Le volume V occupé par une sphère est égal à :
Le rayon étant en mètre, le volume est en mètre cube.
Un atome étant modélisé par une
sphère de rayon r, et N étant
égal au nombre d’atomes équivalents
dans la maille cubique d’arête de
longueur a, la
compacité C est égale
à : 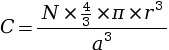 .
.
Le rayon r et la longueur de l’arête a doivent être dans la même unité de longueur.
Pour un réseau cubique simple, on peut calculer la compacité en utilisant la relation mathématique entre le rayon r d’un atome et la longueur a de l’arête du cube. Dans le cadre du modèle des sphères tangentes, les atomes s’organisent selon le schéma suivant.
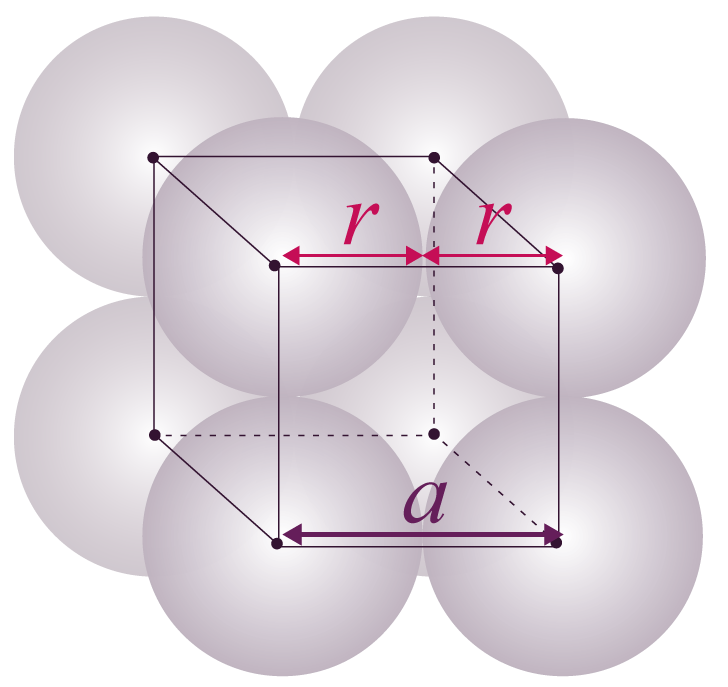
Illustration de la relation entre le rayon atomique r et la longueur de l’arête a
Pour calculer la compacité d’un réseau cubique simple, il faut :
- exprimer le rayon atomique r en fonction de la
longueur de l’arête a :
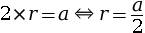
- remplacer le rayon r par son expression en
fonction de a dans la formule de la
compacité :
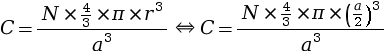
- remplacer N par sa valeur qui est
égale à 1 dans la formule de la
compacité, puis procéder au
calcul :
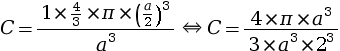
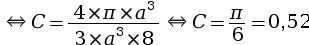
La compacité d’un réseau cubique simple est égale à 0,52, ce qui signifie que la matière atomique occupe 52 % de la maille, le reste (soit 48 %) étant occupé par du vide.
Pour le calcul, il faut connaitre les puissances de deux : 21 = 2 ; 22 = 2 × 2 = 4 ; 23 = 2 × 2 × 2 = 8.
La compacité est indépendante de la nature des atomes de la maille.
Pour un réseau cubique à faces centrées, on peut calculer la compacité en utilisant la relation mathématique entre le rayon r d’un atome et la longueur a de l’arête du cube. Dans le cas du modèle des sphères tangentes, les atomes s’organisent selon le schéma suivant.
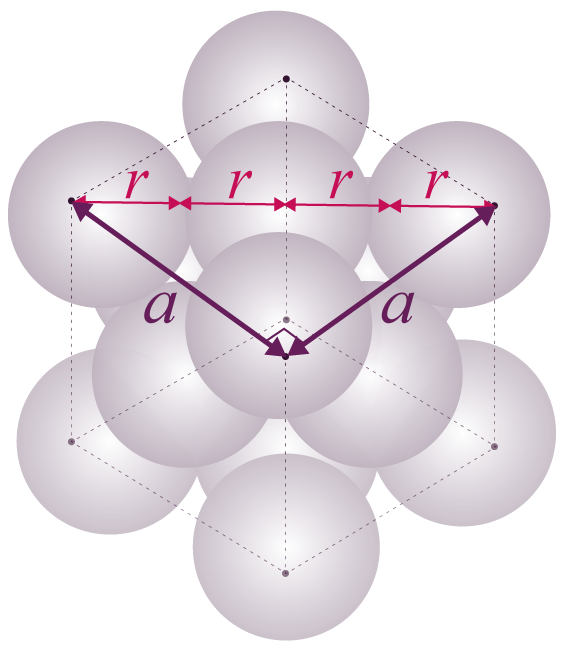
Illustration de la relation entre le rayon atomique r et la longueur de l’arête a
Considérons un triangle rectangle ABC, rectangle en A.
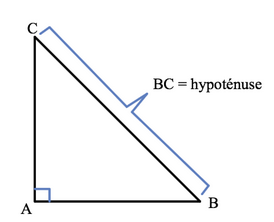
Dans le réseau cubique face centrée, on peut identifier chacun des côtés du triangle rectangle : BC = 4 × r ; AB = a ; AC = a.
Pour calculer la compacité d’un réseau cubique à faces centrées :
- exprimer le rayon atomique r en fonction de la
longueur de l’arête a :
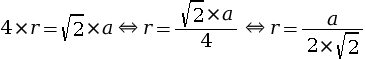
- remplacer le rayon r par son expression en
fonction de a dans la formule de la
compacité :
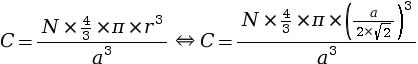
- remplacer N par sa valeur qui est
égale à 4 dans la formule de la
compacité puis on procède au
calcul :
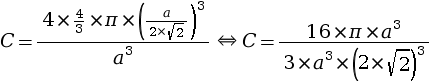
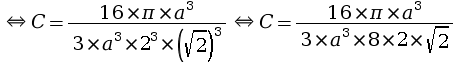
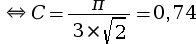
La compacité d’un réseau cubique à faces centrées est égale à 0,74, ce qui signifie que la matière atomique occupe 74 % de la maille, le reste (soit 26 %) étant occupé par du vide.
Pour le calcul, il faut connaitre les puissances de racine de deux :
Elle est notée ρ et a pour unité le kilogramme par mètre cube (kg·m–3).
![]()
La masse volumique peut s’exprimer dans d’autres unités en fonction des unités de la masse et du volume :
1 m3 = 103 dm3 = 106 cm3 et 1 dm3 = 1 L = 103 mL
1 kg = 103 g = 106 mg
La masse volumique d’un cristal se calcule en
divisant la masse des atomes présents dans la
maille par le volume de la maille.
Pour un nombre équivalent d’atomes
égal à N dans la maille, la
masse d’un atome étant égale
à matome, dans
une maille cubique dont la longueur des arêtes
est égale à a, la masse volumique a
pour expression : ![]() .
.

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !









