Réaliser un titrage avec suivi pH-métrique
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
- Mettre en œuvre le suivi pH-métrique d’un titrage qui a pour support une réaction acide-base.
- Exploiter un titrage avec suivi pH-métrique pour déterminer une quantité de matière, une concentration ou une masse.
- Le titrage d’une solution se réalise en versant une solution titrante de concentration connue sur la solution à titrer.
- Le titrage avec suivi pH-métrique consiste à repérer l’équivalence par un changement de saut de pH.
- À l’équivalence, on peut écrire CA × VA = CB × VB(éq), pour une solution acide SA (solution titrée) et une solution basique SB (solution titrante).
- Titrage, quantité de matière
- Formule
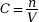
- Équation de réaction acide-base
On étudie ici deux couples acide-base (cas général).
- Un acide AH et sa base conjuguée A− qui forment un couple acide-base noté AH / A−.
- Une base B et son acide conjugué BH+ qui forment un couple acide-base noté BH+ / B.
L’équation de cette réaction s’écrit : AH + B = A− + BH+.
Un acide réagit forcément avec une base et inversement. Deux acides ne peuvent pas réagir entre eux, de même que deux bases ne peuvent pas réagir entre elles.
La finalité d’un titrage pH-métrique est de déterminer la concentration CA d’un acide en solution en faisant réagir deux solutions entre elles.
- Une solution SA contenant un acide AH de concentration CA inconnue (solution titrée).
- Une solution SB contenant une base B de concentration CB connue (solution titrante).
Au cours de ce titrage, on étudie la variation de pH de la solution titrée acide au fur et à mesure que la solution de base titrante de concentration connue est versée. On va obtenir un saut de pH qui va nous permettre de retrouver indirectement la concentration en quantité de matière recherchée.
On peut aussi déterminer la concentration d’une base par titrage pH-métrique. Pour titrer une base avec un acide, la base est dans la solution titrée et l’acide est la solution titrante.
Le titrage d’une solution nécessite l’utilisation du matériel de chimie suivant.
- Bécher
- Burette graduée
- Agitateur magnétique + barreau aimanté
- Support pour la burette graduée
- Pipette jaugée + pipeteur
- Eau distillée
- pH-mètre
Le titrage nécessite deux solutions : une titrée et une titrante.
La solution SA contient un acide AH de concentration en quantité de matière CA (en mol·L−1) : c’est la concentration du réactif titré A. La concentration CA est inconnue et on cherche à l’estimer.
Cette solution a pour volume VA (en L) : c’est le volume fixe de la solution titrée au début de la manipulation, qui se trouve dans le bécher.
La solution SB contient une base B de concentration en quantité de matière CB (en mol·L−1) : c’est la concentration de réactif titrant B. La concentration CB doit être connue avec précision.
Cette solution a pour volume VB (en L) : c’est le volume de réactif titrant qu’on va ajouter progressivement dans le bécher.
Pour réaliser un titrage avec suivi pH-métrique, il faut réaliser les étapes suivantes.
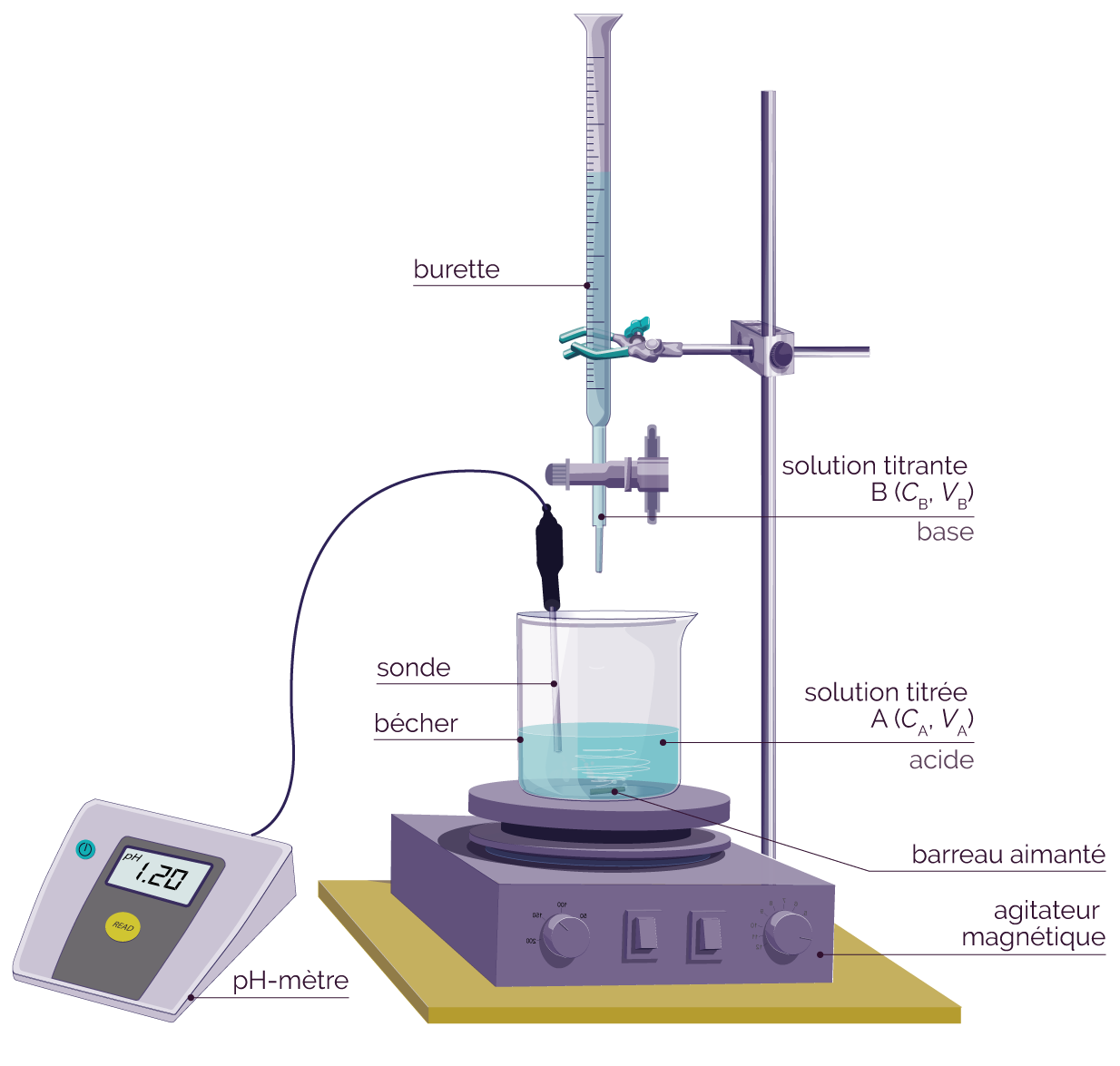
Schéma du titrage
On verse la solution titrante SB contenant la base dans la burette graduée.
Le volume VA de la solution titrante SA contenant l’acide doit être précis.
On le prélève à l’aide d’une pipette jaugée et d’un pipeteur. On l’introduit ensuite dans le bécher.
- On met en route l’agitateur magnétique et on allume le pH-mètre.
- On fait ensuite réagir la
solution SB contenue dans la
burette (réactif titrant) avec la
solution SA contenue dans le
bécher (réactif titré).
-
On introduit pour cela le réactif titrant B dans le bécher par paliers de 1 mL, en ouvrant légèrement le robinet de la burette.
- En parallèle, on note la valeur affichée par le pH-mètre ainsi que le volume de solution titrante versé. Pour chaque volume versé, on note le pH de la solution située dans le bécher en prenant soin d’attendre que la valeur se stabilise.
-
- Lorsqu’on remarque que le pH évolue de manière plus importante, on fait alors couler la solution titrante par paliers de 0,5 mL (alentours du saut de pH).
- Lorsque le pH ne varie plus de manière importante, on peut effectuer de nouveau des paliers de 1 mL.
- On trace ensuite la courbe représentant le pH en fonction du volume de la solution B versée.
Lors du titrage d’un acide AH, ce dernier est progressivement consommé par l’ajout de la base titrante B, de manière irréversible (un titrage est une méthode de dosage destructive). Quand tout l’acide AH est consommé, on atteint l’équivalence.
Lorsque la solution titrante qui contient le réactif basique B est introduite dans la solution titrée contenant le réactif acide AH, il se produit la réaction suivante : AH + B = A− (aq) + BH+ (aq).
À l’équivalence, les réactifs A et B ont été introduits dans les proportions stœchiométriques, on peut donc écrire la relation suivante.
|
CA × VA = CB × VB(éq) |
avec :
|
On en déduit ainsi la concentration
recherchée : ![]() .
.
Pour titrer une base B de concentration CB par un acide AH, le raisonnement est identique et on obtient à l’équivalence :
Une fois qu’on a calculé la concentration recherchée, il est possible de calculer la quantité de matière ou la masse correspondante en utilisant les formules suivantes.
|
n = C × V |
avec :
|
|
m = n × M |
avec :
|
Pour estimer CA, il faut déterminer VB(éq), c’est-à-dire détecter l’équivalence.
Lors du titrage pH-métrique d’un acide, le pH est initialement faible car la solution titrée est acide. Il augmente ensuite au fur et à mesure que l’on introduit la base titrante. L’équivalence acido-basique se manifeste par un saut de pH.
Le point d’équivalence a pour ordonnée le pH à l’équivalence et pour abscisse VB(éq).
Pour déterminer le saut de pH, on peut utiliser la méthode des tangentes parallèles.
- On trace une tangente à la courbe de part et d’autre du saut de pH. Ces deux tangentes doivent être parallèles entre elles.
- On trace ensuite une droite perpendiculaire à ces deux tangentes. Au milieu de cette perpendiculaire, on trace une troisième tangente parallèle aux deux autres.
- Le point équivalent correspond au point d’intersection entre cette troisième tangente et la courbe.
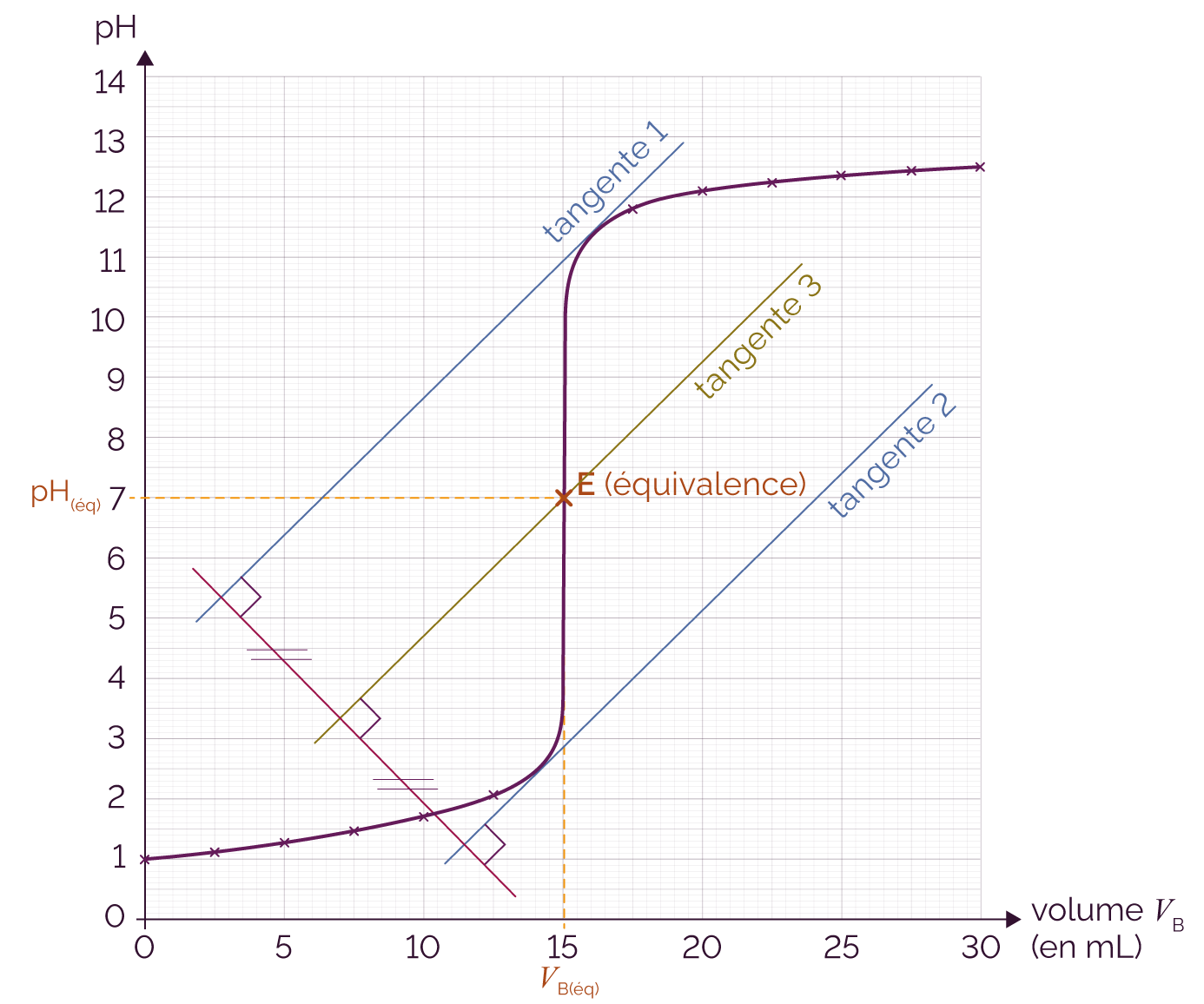
Méthode des tangentes parallèles
Lors du titrage d’une base, la courbe de suivi pH-métrique est décroissante.

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








