Facteurs cinétiques et catalyseurs
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
- Distinguer une réaction chimique rapide d’une réaction chimique lente.
- Mettre en évidence des facteurs cinétiques et l’effet d’un catalyseur.
- Déterminer la durée d’une réaction rapide.
- Une transformation chimique est rapide si elle semble achevée dès la mise en contact des réactifs.
- Une transformation chimique est lente si sa durée est comprise entre quelques secondes et plusieurs minutes.
- Les facteurs cinétiques tels que la température ou la concentration des réactifs influent sur la rapidité de la transformation chimique.
- La durée d’une transformation chimique diminue lorsque la température est plus élevée et la concentration des réactifs est plus grande.
- Un catalyseur est une espèce chimique qui accélère une transformation chimique lente mais qui n’apparait pas dans l’équation de la réaction chimique.
- Réaction chimique : réactifs et produits
- Équation de la réaction chimique
On distingue deux types de réactions chimiques en fonction de leur évolution temporelle : les réactions rapide et les réaction lentes.
- Les réactions rapides semblent achevées dès la mise en contact des réactifs. La durée de la réaction est trop petite pour que l’évolution soit suivie à l’œil nu.
- La durée des réactions lentes peut varier de quelques secondes à plusieurs minutes. Ces réactions peuvent être suivies à l’aide d’appareils de mesure (spectrophotomètre, pressiomètre, etc.).
- La réaction entre l’ion permanganate (couleur violette) et l’ion fer II (incolore) est rapide. La couleur violette due à l’ion permanganate disparait dès sa mise en contact avec l’ion fer II : la réaction semble instantanée.
- La réaction entre l’ion permanganate (couleur violette) et l’acide oxalique (incolore) est lente. La couleur violette due à l’ion permanganate persiste au début, après la mise en contact avec l’ion fer II, puis disparait progressivement au cours du temps.
On peut estimer la durée d’une
réaction lente à partir des courbes de
l’évolution des quantités de
matière des réactifs ou des produits.
La réaction s’achève en effet
lorsque l’un des deux réactifs est
totalement consommé (appelé le
réactif limitant) : sa quantité de
matière est alors égale à
zéro mole. Les quantités de
matière des produits formés et du
réactif en excès n’évoluent
plus au cours du temps.
Une lecture graphique permet de déterminer la durée de la réaction, à partir des courbes des quantités de matière en fonction du temps.
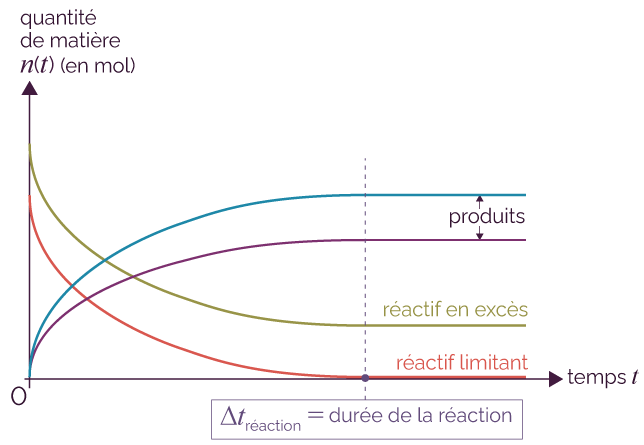
Courbes d’évolution temporelle des quantités de matière
On peut aussi déterminer la durée de la réaction à partir des courbes d’évolution temporelle des concentrations des réactifs et des produits.
Les facteurs cinétiques tels que la température ou la concentration des réactifs influent sur la rapidité de la transformation chimique.
On réalise la transformation chimique au cours
de laquelle l’acide oxalique
H2C2O4 réagit
avec l’ion permanganate MnO![]() . L’acide oxalique est
incolore et l’ion permanganate est violet. Cette
réaction est lente.
. L’acide oxalique est
incolore et l’ion permanganate est violet. Cette
réaction est lente.
L’équation de la réaction chimique est la suivante.
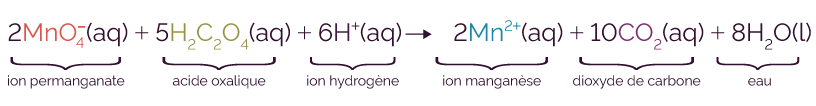
Les réactifs sont l’ion permanganate et l’acide oxalique, tandis que les produits sont l’ion manganèse et le dioxyde de carbone.
La présence de l’ion hydrogène dans l’équation signifie que la réaction doit s’effectuer en milieu acide. Il est toujours présent en excès afin de ne pas limiter la réaction. La réaction se faisant en solution aqueuse, l’eau est en excès car il s’agit du solvant. Ces deux entités ne sont pas prises en compte pour étudier l’évolution temporelle de la réaction.
On obtient les courbes d’évolution des concentrations des réactifs et des produits au cours du temps, ce qui permet de déterminer la durée de la réaction Δtréaction.
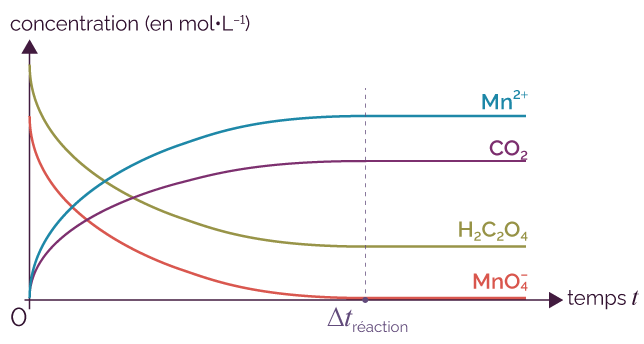
Évolution temporelle des concentrations
au cours de la réaction
Pour un même système chimique initial, c’est-à-dire que les quantités de matière initiales des entités chimiques présentes sont les mêmes, on réalise la réaction à des températures différentes.
On trace sur un même graphique les courbes de l’évolution temporelle de la concentration de l’ion permanganate, pour les différentes expériences à des températures différentes.
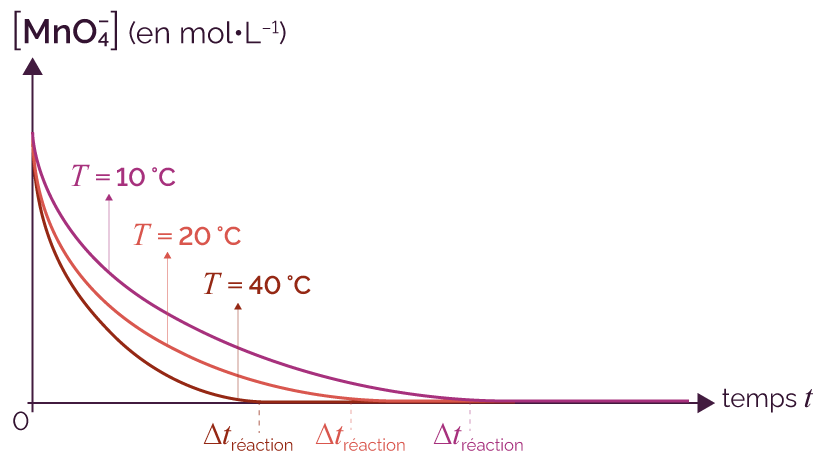
Évolution temporelle de la concentration
en ion permanganate
On constate que la durée de la réaction est une fonction décroissante de la température à laquelle s’effectue la réaction chimique.
Cette étude aurait pu aussi se faire avec la concentration de l’autre réactif (acide oxalique) ou des produits (ion manganèse ou dioxyde de carbone).
On réalise la transformation chimique au cours
de laquelle l’acide
oxalique H2C2O4
réagit avec l’ion
permanganate MnO![]() . L’acide oxalique est
incolore et l’ion permanganate est violet. Cette
réaction est lente.
. L’acide oxalique est
incolore et l’ion permanganate est violet. Cette
réaction est lente.
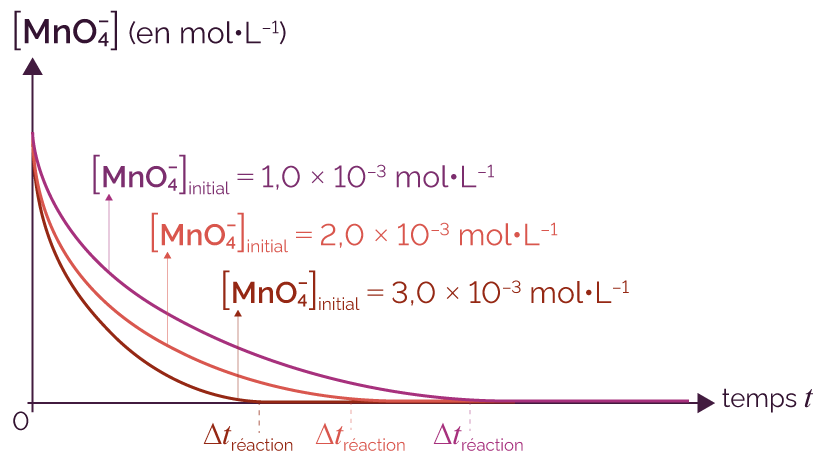
Le tableau suivant indique les concentrations initiales des réactifs pour trois expériences.
| Expérience 1 | Expérience 2 | Expérience 3 | |
|
[MnO |
1,0 × 10–3 | 2,0 × 10–3 | 3,0 × 10–3 |
| [H2C2O4]initial (en mol·L–1) | 1,0 × 10–2 | 1,0 × 10–2 | 1,0 × 10–2 |
- La température est fixée à la même valeur pour les trois expériences.
- La concentration initiale en acide oxalique est la même dans les trois expériences car on ne fait varier qu’un seul paramètre : on étudie uniquement l’effet de la concentration initiale en ion permanganate.
On trace les courbes de l’évolution temporelle de la concentration de l’ion permanganate sur un même graphique, pour les différentes expériences à des concentrations initiales différentes.
Évolution temporelle de la concentration
en ion permanganate
On constate que la durée de la réaction est une fonction décroissante de la concentration initiale en ion permanganate.
Cette étude aurait pu aussi se faire avec la concentration initiale de l’autre réactif (acide oxalique).
Il existe d’autres facteurs cinétiques qui peuvent influer sur la rapidité d’une réaction chimique : les radiations lumineuses et le solvant utilisé.
Les radiations lumineuses, infrarouges ou ultraviolettes jouent un rôle dans les réactions photochimiques.
Une réaction photochimique est une réaction dans laquelle les radiations sont absorbées par les espèces chimiques réactives, ce qui leur permet de pouvoir réagir.
Un flux radiatif intense permet d’accélérer la réaction.
On étudie la réaction entre le dihydrogène H2 et le dichlore Cl2.
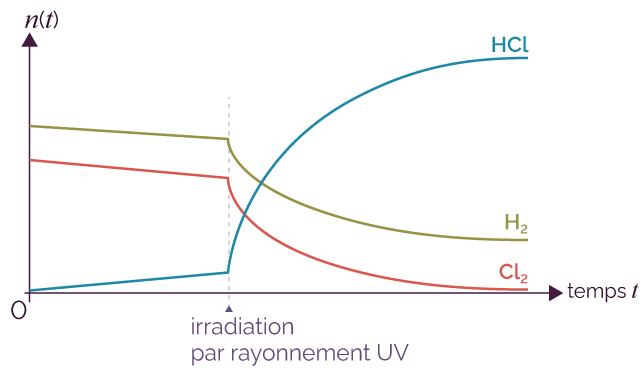
Évolution avant et après une irradiation au rayonnement UV
Le solvant est le liquide dans lequel les réactifs se trouvent dissous.
La rapidité de la réaction peut être plus ou moins grande en fonction du solvant choisi.
La réaction entre un alcool (de formule générale R–OH) et un acide carboxylique (de formule générale R’–CO2H) donne comme produits un ester (de formule générale R–CO2–R’) et de l’eau. Cette réaction peut être catalysée par l’acide sulfurique de formule H2SO4.
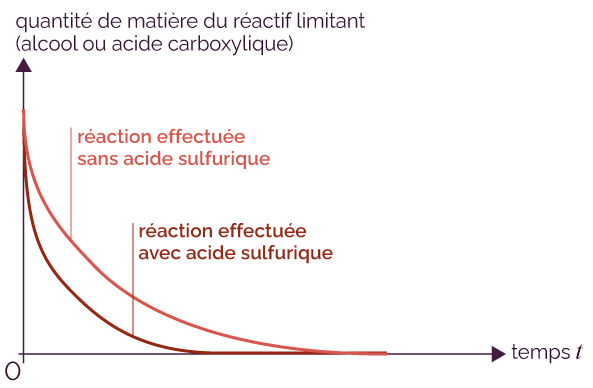
Évolution temporelle de la quantité de réactif limitant
Un catalyseur est une espèce chimique qui va réagir avec les réactifs afin d’accélérer la formation des produits, tandis que les facteurs cinétiques sont des grandeurs caractéristiques du système chimique (concentration des réactifs, température, etc.).

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








