Déterminer un taux d'avancement à l'état final
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
Déterminer un taux d’avancement final à partir de données sur la composition de l’état final et le relier au caractère total ou non total de la transformation.
- L’état d’un système chimique siège d’une transformation chimique évolue entre un état initial et un état final.
- Une réaction est totale si au moins un des deux réactifs a complètement disparu à la fin de la réaction ; une réaction est non totale si tous les réactifs et produits coexistent à la fin de la réaction.
- Le caractère total ou non total d’une réaction chimique nous est donné par le calcul du taux d’avancement, qui est égal au rapport de l’avancement final xf de la réaction sur l’avancement maximal xmax.
- Une réaction est totale si son taux d’avancement est égal à un. Si le taux d’avancement est strictement compris entre zéro et un, la réaction est non totale. Si le taux d’avancement est égal à zéro, la réaction n’a pas eu lieu.
- Un tableau d’avancement permet de déterminer, à partir de l’état initial, les quantités de matière des réactifs et des produits dans l’état final. La recherche de l’avancement maximal se fait en identifiant le réactif limitant.
- L’avancement final peut être déterminé expérimentalement par une mesure de pH, d’absorbance, de conductivité ou par le dosage d’une des espèces chimiques produites.
- Tableau d’avancement
- Concentration en quantité de matière
- Mesurer un pH, une absorbance, une conductivité
- Réaliser un dosage
- Loi de Beer-Lambert, relation du pH
Lorsqu’un système chimique est le siège d’une transformation chimique, celui-ci évolue entre un état initial (quantités de matière des réactifs et des produits introduits au début de la réaction) et un état final (quantités de matière des réactifs qui n’ont pas totalement réagi et celles des produits qui ont été formés).
En fonction de la composition de l’état final, on distingue les réactions totales des réactions non totales.
L’avancement maximal correspond à ce qu’on obtiendrait si la réaction était totale, il tient compte du réactif limitant. L’avancement final correspond à ce que l’on va réellement obtenir si la réaction n’est pas totale.
La comparaison de l’avancement maximal xmax et de l’avancement final xf permet de déterminer si la réaction est totale ou non totale.
- Si xmax > xf, la réaction est non totale.
- Si xmax = xf, la réaction est totale.
Les avancements sont exprimés en mole et sont déterminés grâce au tableau d’avancement.
|
|
avec :
|
Les deux avancements peuvent être en millimole : le rapport des deux donnera la même valeur du taux d’avancement final.
On peut alors définir un critère pour évaluer si une réaction est totale ou non totale.
- Si 1 > τ > 0, la réaction est non totale.
- Si τ = 1, la réaction est totale.
Le taux d’avancement final est compris
entre 0 et 1 (car xmax est
toujours supérieur ou égal
à xf), on peut
donc également exprimer sa valeur en pourcentage
(1 = 100 % ;
0,5 = 50 % ;
0 = 0 %).
Si le taux d’avancement final est égal
à zéro, cela signifie que la
réaction n’a pas eu lieu.
Pour trouver la valeur du taux d’avancement final τ, il faut connaitre les valeurs de l’avancement final xf et de l’avancement maximal xmax.
Un avancement maximal se calcule, quelle que soit la réaction, à partir du tableau d'avancement. Il se calcule à partir de la consommation totale d'un des réactifs. Si la réaction est totale alors l'avancement final coïncide avec, sinon l'avancement final se détermine expérimentalement.
On considère une réaction chimique, dont l’équation chimique est la suivante.
| a A + b B → c C + d D |
avec :
|
Le tableau d’avancement associé à cette réaction est le suivant.
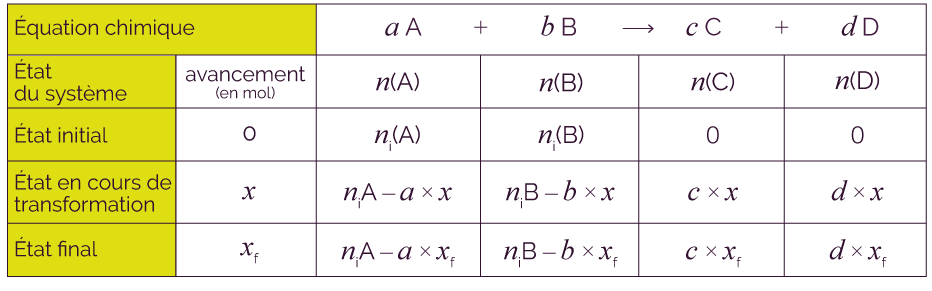
Dans une réaction totale, l’avancement maximal xmax est égal à la valeur de l’avancement dans l’état final car l’un des deux réactifs est totalement consommé.
-
Hypothèse 1 : le
réactif A est le réactif
limitant.
nf(A) = 0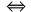 ni(A) – a × x = 0
ni(A) – a × x = 0 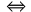 xmax =
xmax = 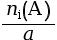
-
Hypothèse 2 : le
réactif B est le réactif
limitant.
nf(B) = 0 ni(B) – b × x = 0
ni(B) – b × x = 0  xmax =
xmax = 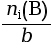
L’avancement maximal est égal à la plus petite des deux valeurs des avancements maximaux calculés.
Dans le cas d’une réaction totale, l’un des réactifs (ou les deux) est totalement consommé, l’avancement final coïncide avec l’avancement maximal.
Dans une réaction non totale, l’ensemble des réactifs et produits coexistent. Dans ce cas, l’avancement maximal que l’on calcule à partir du tableau d’avancement est forcément supérieur à l’avancement final que l’on détermine expérimentalement.
La détermination expérimentale de
l’avancement final xf
nécessite de réaliser la
détermination d’une grandeur
(concentration, absorbance, pH, etc.) attachée
au système chimique à la fin de la
réaction.
Cette mesure est alors reliée à la
quantité de matière du réactif ou
du produit dans l’état final, ce qui
permet de trouver l’expression de
l’avancement final grâce au tableau
d’avancement et de le calculer.
On applique la loi de Beert-Lambert, qui lie l’absorbance A mesurée à la concentration en quantité de matière Cf de l’espèce colorée dans l’état final.
A = k × Cf
On exprime la quantité de matière finale en fonction de A et du volume réactionnel Vréac.
A = k × Cf ![]() A = k ×
A = k × ![]()
![]() nf =
nf = ![]()
Cette quantité de matière finale est reliée à celle qui est exprimée dans le tableau d’avancement.
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Une fois le dosage réalisé et la concentration en quantité de matière finale déterminée, on applique la relation de la concentration en quantité de matière.
![]()
Cette quantité de matière finale est reliée à celle qui est exprimée dans le tableau d’avancement
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
On applique la relation du pH, qui lie le pH à la concentration en quantité de matière de l’ion oxonium dans l’état final.
![]()
On exprime la quantité de matière finale en ions oxonium en fonction du pH et du volume réactionnel Vréac.
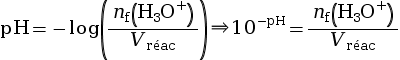 (car 10log x = x)
(car 10log x = x)
![]()
Cette quantité de matière finale est reliée à celle qui est exprimée dans le tableau d’avancement.
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








