Exploiter une électrolyse
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
- Modéliser et schématiser, à partir de résultats expérimentaux, les transferts d’électrons aux électrodes par des réactions électrochimiques.
- Déterminer les variations de quantité de matière à partir de la durée de l’électrolyse et de la valeur de l’intensité du courant.
- Identifier les produits formés lors du passage forcé d’un courant dans un électrolyseur. Relier la durée, l’intensité du courant et les quantités de matière de produits formés.
- L’électrolyse est une réaction forcée qui se déroule dans le sens inverse de la réaction qui a lieu spontanément. Elle se déroule grâce au passage d’un courant.
- L’électrode reliée à la borne négative du générateur est appelée « cathode ». Elle est le siège d’une réduction.
- L’électrode reliée à la borne positive du générateur est appelée « anode ». Elle est le siège d’une oxydation.
Couple oxydant-réducteur, demi-équation d’oxydoréduction, réaction d’oxydoréduction
Une réaction d’oxydoréduction met en jeu un oxydant Ox1 qui appartient à un couple Ox1 / Red1, avec un réducteur Red2 qui appartient au couple Ox2 / Red2 selon la réaction suivante.
Ox1 + Red2 → Red1 + Ox2
L’oxydant du couple 1, Ox1, subit une réduction selon l’équation : Ox1 + n1 e− = Red1, avec n1 le nombre d’électrons échangés.
Le réducteur du couple 2, Red2, subit une oxydation selon l’équation : Red2= Ox2+ n2 e−, avec n2 le nombre d’électrons échangés.
On étudie la réaction entre :
- le cuivre Cu, solide de couleur rougeâtre ;
- le dibrome Br2, solution de couleur orangée.
Pour cela, on plonge une plaque de cuivre Cu dans une solution contenant du dibrome Br2.

Après quelques heures, on remarque que la solution se colore en bleu et que la plaque de cuivre a été rongée.
Il s’est passé une réaction d’oxydoréduction entre le cuivre Cu et le dibrome Br2.
- Le cuivre Cu appartient au couple Cu2+ / Cu. Il subit une oxydation selon l’équation Cu (s) → Cu2+ (aq) + 2 e–.
- Le dibrome Br2 appartient au couple Br– / Br2. Il subit une réduction selon l’équation Br2 (aq) + 2 e– → 2 Br– (aq).
L’équation de la réaction d’oxydoréduction s’écrit :
Cu (s) + Br2 = Cu2+ (aq) + 2 Br– (aq)
Cette équation permet d’expliquer :
- l’apparition de la couleur bleue due à la formation des ions Cu2+ ;
- la diminution du métal cuivre Cu due à sa consommation ;
- la consommation du dibrome Br2 qui explique la disparition de la couleur orangée.
Lors de la mise en contact des deux réactifs Cu et Br2, la réaction évolue spontanément, sans apport d’énergie.
On étudie cette fois-ci la réaction inverse de la réaction précédente, c’est-à-dire, la réaction entre :
- les ions cuivre Cu2+, bleus en solution ;
- les ions brome Br–, incolores en solution.
On mélange pour cela une solution contenant des
ions cuivre Cu2+ avec une solution
contenant des ions bromure Br– dans un tube
en U.
On plonge deux électrodes de graphite (elles
sont inertes chimiquement donc elles ne vont pas
réagir avec les réactifs) dans la
solution, qu’on relie à un
ampèremètre.
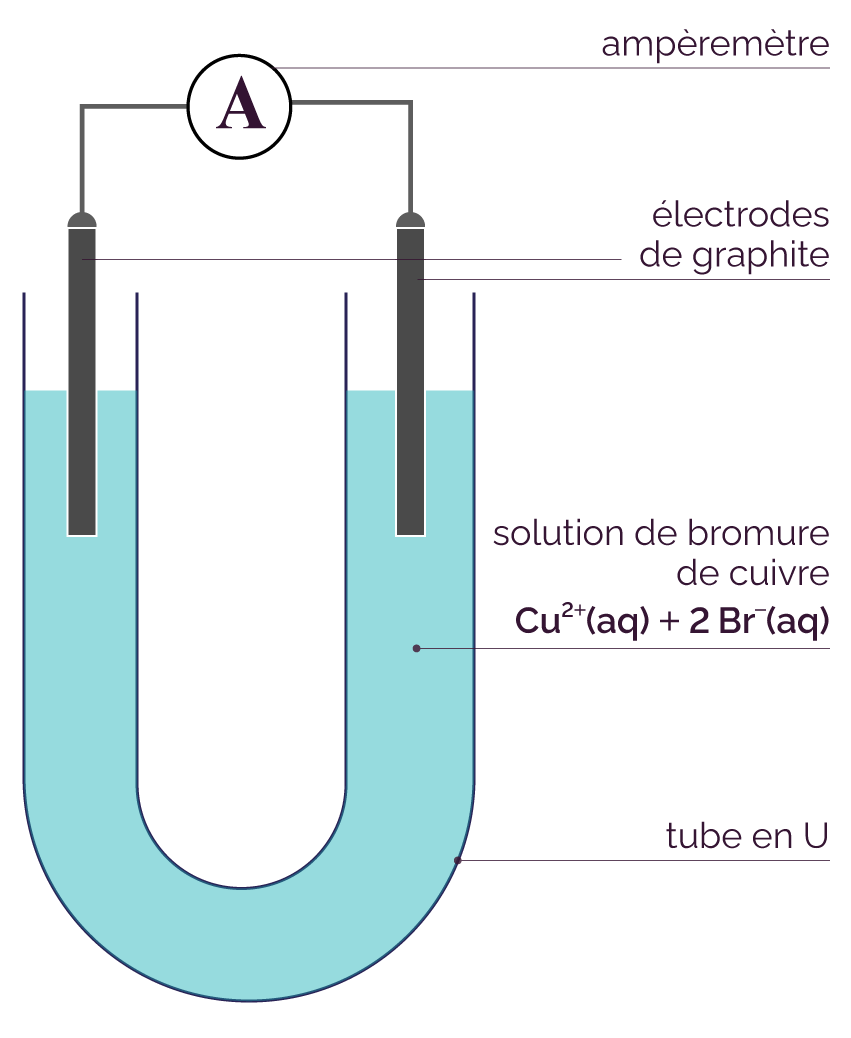
Schéma de l’expérience
On ne remarque aucune évolution de la réaction :
- Il n’y a pas de changement de couleur de la solution ;
- Il n’y a pas de formation de solide sur les électrodes ;
- L’ampèremètre affiche une valeur nulle.
S’il n’y a pas de courant qui circule dans le circuit, cela veut dire qu’il n’y a pas de déplacements d’électrons dans le circuit et donc pas de réaction d’oxydoréduction. L’absence de changement de couleur confirme cette conclusion.
Lors de la mise en contact des deux réactifs Cu2+ et Br–, la réaction ne se déroule pas.
On va chercher à forcer cette réaction chimique. On relie pour cela le circuit à un générateur pour faire circuler un courant (et donc des électrons).
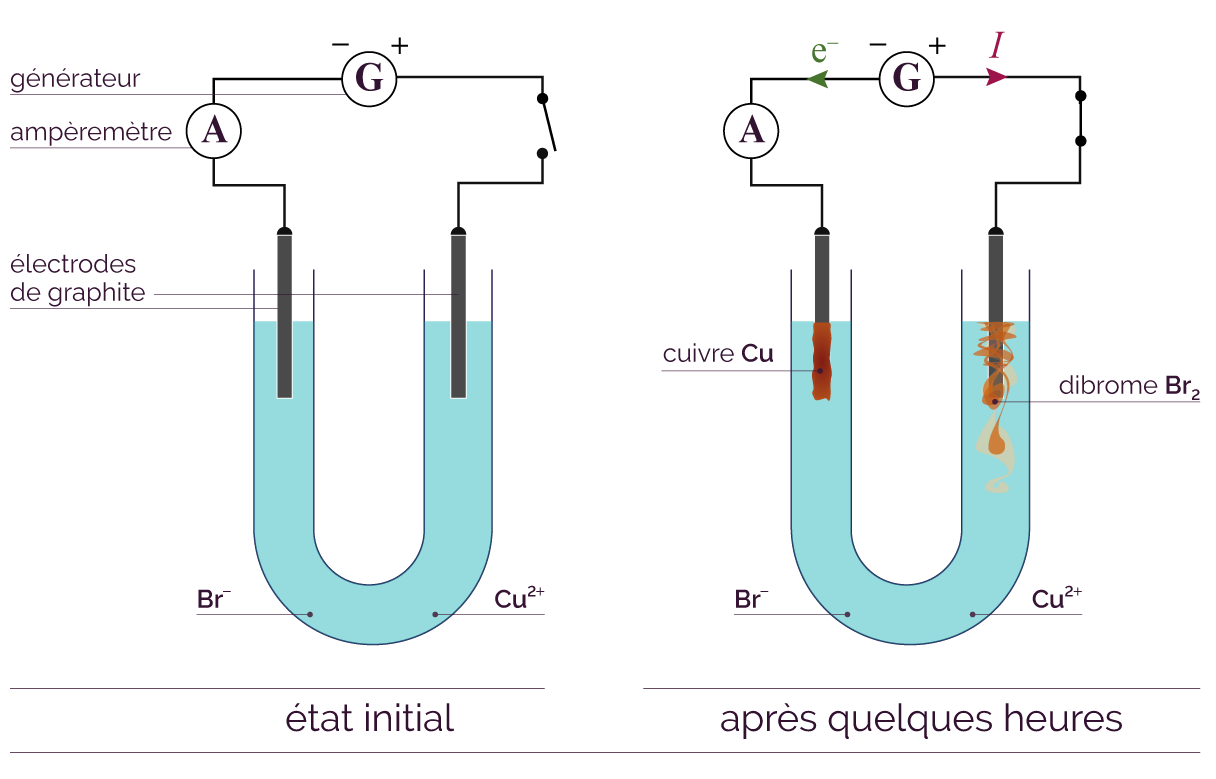
On remarque après quelques heures :
- la formation d’un solide rougeâtre sur l’électrode reliée à la borne négative du générateur ;
- l’apparition d’une coloration orangée de la solution sur l’électrode reliée à la borne positive du générateur ;
- une valeur non nulle affichée par l’ampèremètre.
Il s’est passé une réaction d’oxydoréduction entre les ions cuivre Cu2+ et les ions brome Br–.
- Les ions cuivre Cu2+ appartient au
couple Cu2+ / Cu.
Ils subissent une réduction selon l’équation
Cu2+ (aq) + 2 e– → Cu (s). - Les ions brome Br– appartient
au couple Br– / Br2.
Ils subissent une oxydation selon l’équation
2 Br– (aq) → Br2 (aq) + 2 e–.
L’équation de la réaction d’oxydoréduction s’écrit :
Cu2+ (aq) + 2 Br– (aq) = Cu (s) + Br2 (aq)
Cette équation permet d’expliquer :
- l’apparition du solide rougeâtre due à la formation du métal Cu ;
- l’apparition de la couleur orangée due au dibrome Br2.
La réaction d’oxydoréduction a pu se réaliser grâce au passage du courant I dans le circuit. Le passage du courant va imposer le sens de transfert des électrons d’une électrode à l’autre et donc la consommation des électrons sur une électrode (réduction) et la libération d’électrons sur l’autre (oxydation).
Lors de la mise en contact des deux réactifs Cu2+ et Br–, la réaction a pu se réaliser grâce au courant qui circule dans le circuit. La réaction a été forcée : c’est l’électrolyse.
L’électrolyse est la réaction inverse de celle qui se déroule dans une pile.
Un électrolyseur est composé de deux électrodes qui sont plongées dans une solution appelée électrolyte, et d’un générateur de courant continu qui impose le sens de circulation des électrons.
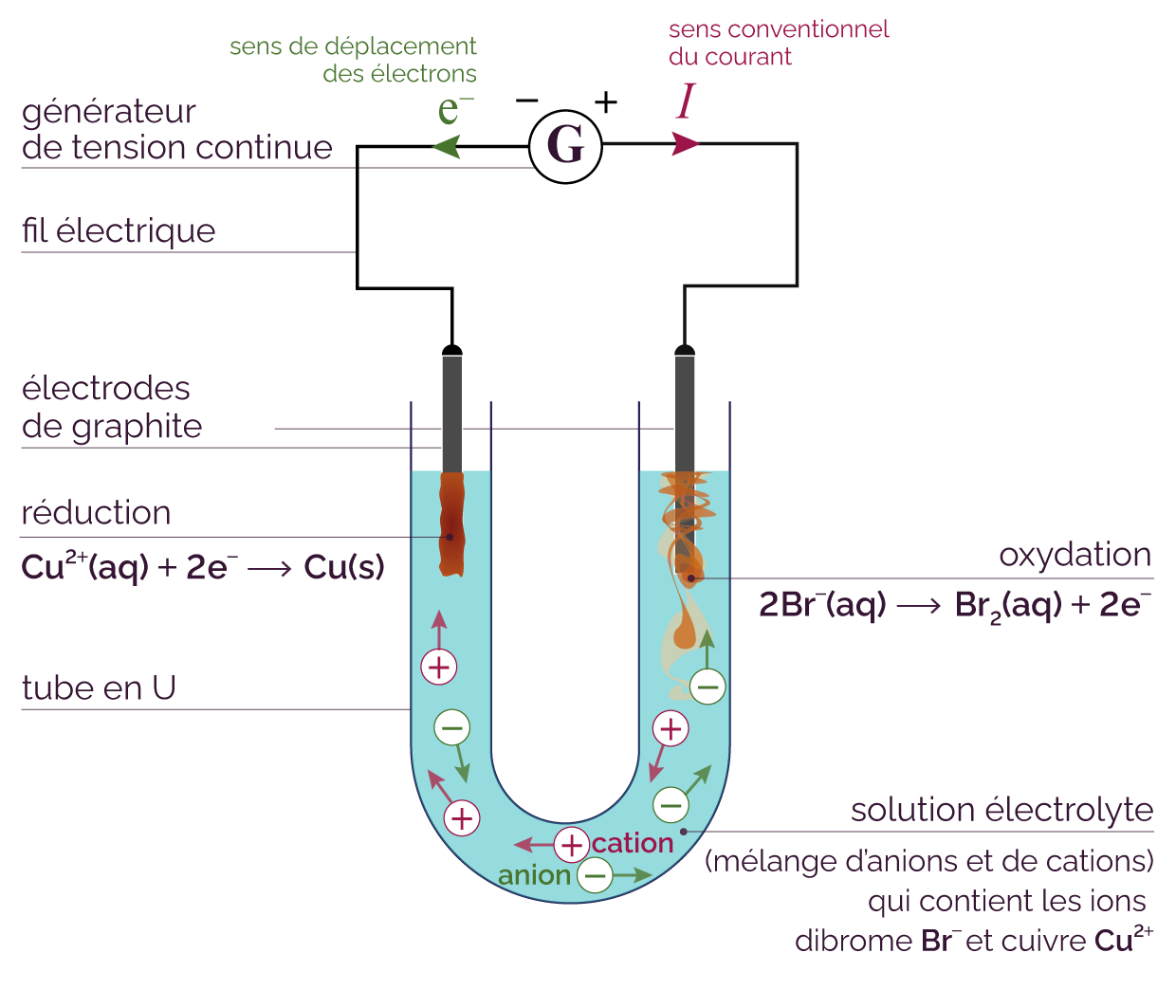
Schéma d’un électrolyseur
Lors de la mise en route du générateur, les électrons vont circuler de la borne négative vers la borne positive du générateur (sens inverse du courant) selon le procédé suivant.
Les cations sont attirés par cette électrode.
Les anions sont attirés par cette électrode.
Les électrons sortent par cette borne car ils sont libérés par les ions brome Br– selon la réaction : 2 Br– (aq) → Br2 (aq) + 2 e–.
Il est possible de relier l’intensité I qui traverse le circuit et la quantité de matière d’électrons n(e–) qui circulent dans le circuit pendant une durée Δt.
On peut ensuite avoir accès à la quantité de matière de produit qui a été formé en s’aidant des réactions qui ont lieu aux bornes des électrodes.
En effet, l’intensité du courant I correspond à une quantité de charge Q par unité de temps (et donc à un débit d’électrons).
|
|
avec :
|
La valeur absolue de la charge Q d’un électron vaut |–e| = 1,6 × 10–19 C.
Si pendant une durée Δt, il y a N électrons qui circulent dans le circuit, alors la charge totale est donnée par la formule suivante.
|
Q = N × e Q = n(e–) × NA × e (car N = n × NA) Q = n(e–) × F (car F = NA × e) |
avec :
|
On obtient finalement la relation entre l'intensité du courant I et la quantité de matière des électrons qui circulent dans le circuit en reliant les deux formules.
|
et Q = n(e–) × F
Soit |
avec :
|
On reprend l’exemple de
l’électrolyse vue
précédemment.
L’équation de la réaction
trouvée est :
Cu2+ (aq) + 2 Br– (aq) = Cu (s) + Br2 (aq)
On cherche à calculer la quantité de matière de cuivre Cu qui s’est formée au bout de 15 minutes, sachant que l’ampèremètre a affiché une valeur de 65 mA.
Donnée : F = 9,65 × 104 C·mol–1.
- On calcule la quantité de matière
d’électrons qui a circulé dans le
circuit.
- On utilise pour cela la formule
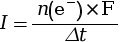 soit
soit 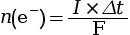 .
.
- On convertit les données dans la bonne
unité :
I = 65 mA = 6,5 × 10–2 A
t = 15 min = 15 × 60 s = 900 s. - Application numérique :
n(e–) =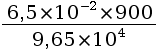
n(e–) = 6,1 × 10–4 mol
- On utilise pour cela la formule
- On utilise ensuite la demi-équation
d’oxydoréduction qui a lieu à
l’électrode où il y a eu formation
de cuivre Cu pour relier la quantité de
matière en cuivre Cu et en
électrons.
- La demi-équation est :
Cu2+ (aq) + 2 e– = Cu (s).
On a donc :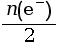 = n(Cu).
= n(Cu).
- Application numérique:
n(Cu) =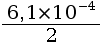
n(Cu) = 3,1 × 10–4 mol
- La demi-équation est :
Cu2+ (aq) + 2 e– = Cu (s).

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








