Identifier la catégorie d'une réaction chimique
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
Identifier des réactions d’oxydoréduction, acide-base, de substitution, d’addition, d’élimination.
- Au cours d’une réaction d’oxydoréduction, un oxydant réagit avec un réducteur en échangeant un ou plusieurs électrons.
- Au cours d’une réaction acido-basique, un acide réagit avec une base en échangeant un proton.
- Au cours d’une réaction de substitution, un atome ou un groupe d'atomes remplace un autre.
- Au cours d’une réaction d'addition, deux atomes ou groupes d'atomes s'ajoutent à une molécule sur une liaison multiple.
- Au cours d’une réaction d'élimination, un atome ou un groupe d'atomes est éliminé d'une molécule.
- Couples oxydant-réducteur, couples acide-base
- Formules semi-développée, développée, topologique
- Groupe fonctionnel
Les réactions chimiques peuvent être classées en différentes catégories selon le type de procédé.
- Passage de deux réactifs à deux produits avec échange de particules (électron ou proton H+).
- Passage d’un ou plusieurs réactifs à un ou plusieurs produits avec modification de la chaine carbonée ou du groupe caractéristique. C’est le principe de la synthèse chimique.
Elle met en jeu les deux réactifs suivants :
- un oxydant Ox1 qui appartient à un couple Ox1 / Red1 ;
- un réducteur Red2 qui appartient à un autre couple Ox2 / Red2.
Au cours de cette réaction, le réducteur Red2 perd un ou plusieurs électrons qui vont être récupérés par l’oxydant Ox1. Le réducteur Red2 subit une oxydation tandis que l’oxydant Ox1 subit une réduction.
L’équation de cette réaction d’oxydoréduction qui a lieu entre l’oxydant Ox1 et le réducteur Red2 s’écrit de la manière suivante.
| a Ox1 + b Red2 = c Ox2 + d Red1 |
| avec a, b, c et d, les coefficients directeurs des réactifs respectifs Ox1, Red2, Ox2 et Red1 |
Un oxydant réagit forcément avec un réducteur et inversement. Deux oxydants ne peuvent pas réagir entre eux, de même que deux réducteurs ne peuvent pas réagir entre eux.
On considère la réaction entre une solution contenant des ions argent Ag+ (oxydant) et de la poudre de zinc Zn (réducteur).
L’équation de cette réaction s’écrit de la manière suivante.
2 Ag+ (aq) + Zn (s) = 2 Ag (s) + Zn2+ (aq)
Il s’agit bien d’une réaction d’oxydoréduction car elle fait intervenir les deux réactifs suivants :
- l’oxydant Ag+ qui appartient au couple Ag+ / Ag ;
- le réducteur Zn qui appartient au couple Zn2+ / Zn.
L’ion Ag+ est l’oxydant, il subit une réduction en gagnant un électron et en se transformant en Ag : Ag+ (aq) + e– = Ag (s).
Le réducteur zinc Zn subit une oxydation en perdant deux électrons et en se transformant en ion Zn2+ : Zn (s) = Zn2+ (aq) + 2 e–.
L’équation d’oxydoréduction fait intervenir un échange d’électrons entre les ions argent Ag+ et le zinc Zn.
Elle met en jeu les deux réactifs suivants :
- un acide A1H qui appartient à un couple A1H / A1–.
- une base A2– qui appartient à un autre couple A2H / A2–.
Au cours de cette réaction, l’acide A1H perd un proton H+ qui va être récupéré par la base A2–.
L’équation de cette réaction acido-basique qui a lieu entre l’acide A1H et la base A2– s’écrit de la manière suivante.
|
A1H (aq) + A2– (aq) = A1– (aq) + A2H (aq) |
Un acide réagit forcément avec une base et inversement. Deux acides ne peuvent pas réagir entre eux, de même que deux bases ne peuvent pas réagir entre elles.
On considère la réaction entre une
solution contenant l’ion ammonium NH![]() , qui est un acide, et
l’ion éthanoate
CH3COO–, qui est une
base.
, qui est un acide, et
l’ion éthanoate
CH3COO–, qui est une
base.
L’équation de cette réaction s’écrit de la manière suivante.
NH![]() (aq) + CH3COO– (aq) = NH3 (aq) + CH3COOH (aq)
(aq) + CH3COO– (aq) = NH3 (aq) + CH3COOH (aq)
Il s’agit bien d’une réaction acido-basique car elle fait intervenir les deux réactifs suivants :
- l’acide NH
 qui appartient au
couple NH
qui appartient au
couple NH / NH3 ;
/ NH3 ;
- la base ion éthanoate CH3COO– qui appartient au couple CH3COOH / CH3COO–.
L’acide NH![]() va se transformer en sa
base conjuguée NH3 en perdant un
proton H+. Ce dernier va
être récupéré par la base
CH3COO– pour se
transformer en acide CH3COOH.
va se transformer en sa
base conjuguée NH3 en perdant un
proton H+. Ce dernier va
être récupéré par la base
CH3COO– pour se
transformer en acide CH3COOH.
Au cours d’une réaction de substitution, un atome ou un groupe d’atomes est remplacé par un autre. On dit qu’il est substitué.
L’équation générale d'une réaction de substitution s'écrit de la manière suivante.
| R — B + A → R — A + B |
avec :
|
Au cours d'une réaction de substitution, le
groupe « B » est remplacé
par le groupe « A ».
Cette réaction de substitution peut modifier la
chaine carbonée de R, ou modifier le groupe
fonctionnel de R.
Une chaine carbonée est modifiée si le nombre ou l’agencement des atomes de carbone n’est pas le même.
On fait réagir le chloroéthane avec l'ion hydroxyde HO–. On obtient l’équation de réaction suivante.
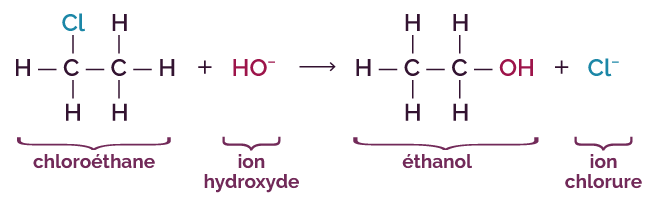
On observe que le chloroéthane a perdu un atome de chlore. Ce dernier a été remplacé par le groupe fonctionnel « OH ».
Le chloroéthane appartient à la famille des halogénoalcanes. Suite à cette réaction de substitution, il s’est transformé en éthanol qui appartient à la famille des alcools. La chaine carbonée n'a pas été modifiée, seul le groupe caractéristique a été transformé.
On fait réagir le benzène avec le chlorométhane. On obtient la réaction suivante.
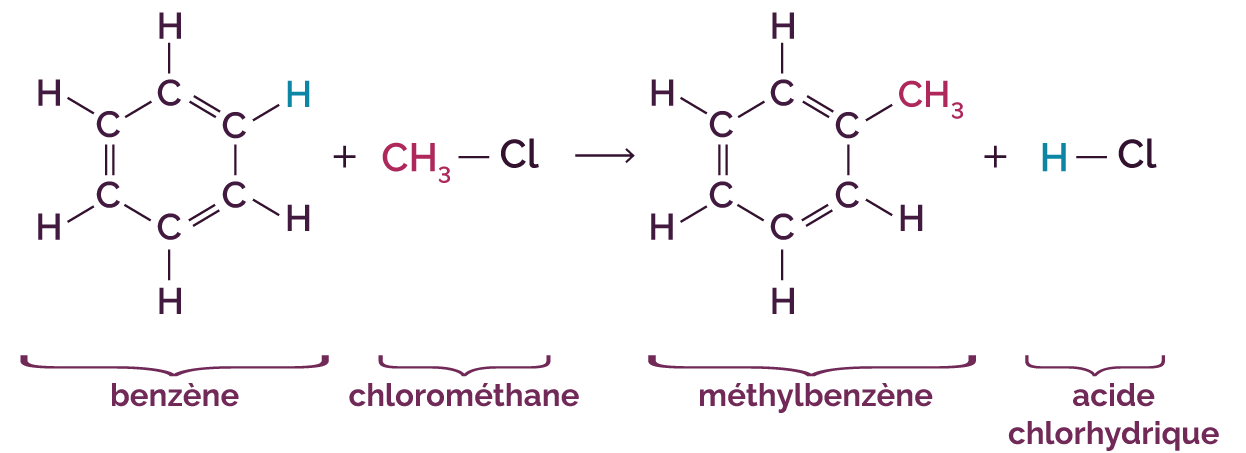
On remarque que le benzène a perdu un hydrogène H. Ce dernier a été remplacé par un groupement méthyle CH3 en modifiant cette fois-ci la chaine carbonée du benzène. Le groupement méthyle (CH3) dans la molécule du chlorométhane a été remplacé par l’hydrogène H libéré par le benzène.
L’équation générale d’une réaction d’addition s'écrit de la manière suivante.
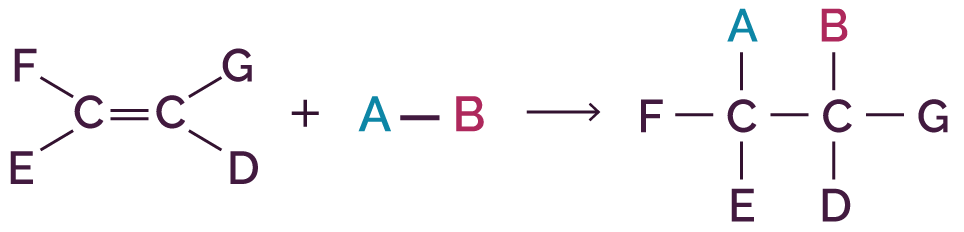
|
avec :
|
Au cours d'une réaction d'addition, la liaison multiple se casse et les groupements A et B s'ajoutent (s’additionnent) de part et d'autre de la liaison cassée, sur chaque atome de carbone.
Une réaction d’addition peut modifier la chaine carbonée de la molécule, selon les atomes qui sont additionnés.
On considère la réaction d’addition du dihydrogène sur un alcène. On fait réagir le propène avec le dihydrogène H2.
On obtient la réaction suivante.
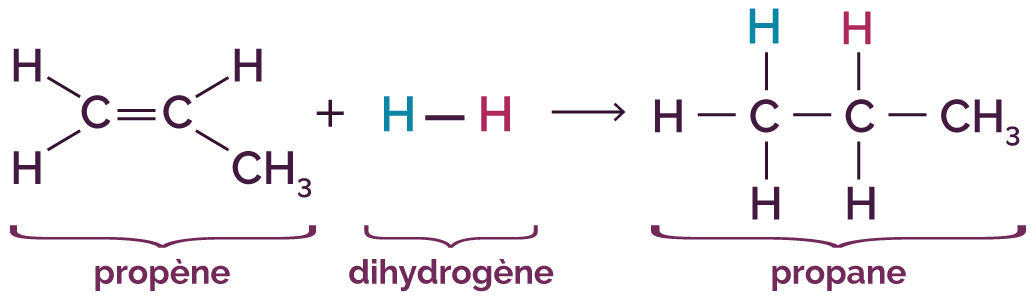
Le squelette carboné du propène était initialement insaturé (présence d’une double liaison). La réaction d’addition a eu pour conséquence de le saturer pour le transformer en alcane.
L’équation générale d’une réaction d’élimination s’écrit de la manière suivante.
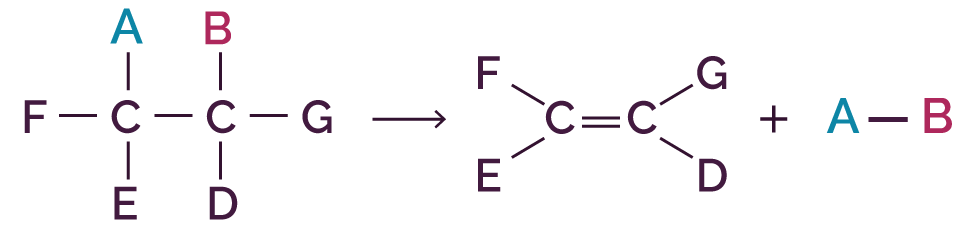
|
| avec A, B, C, D, E des atomes ou groupes d’atomes |
La molécule A — B est éliminée. Au cours d'une réaction d'élimination, une liaison multiple se forme. La réaction d'élimination est la réaction inverse de la réaction d'addition.
On considère la réaction d’élimination de l’éthanol.
L’équation de la réaction s’écrit de la manière suivante.
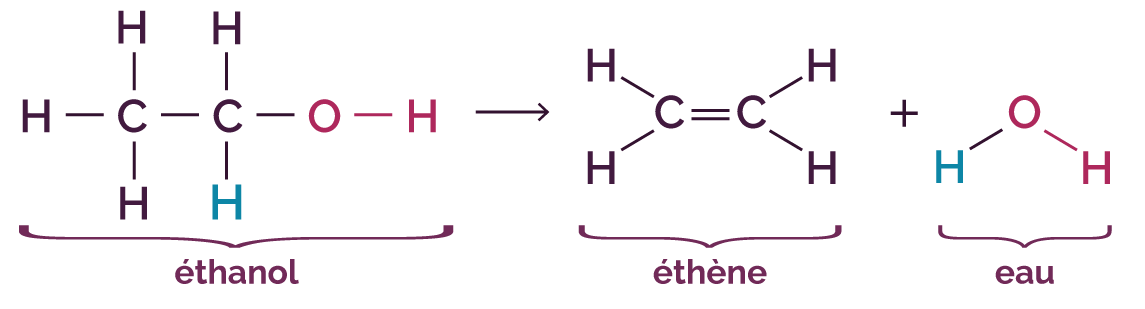
On remarque que le groupe fonctionnel alcool « OH » et un atome H présent sur un carbone de l’éthanol ont disparu au profit d’une double liaison. La molécule a été éliminée.

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








