Étudier la réaction entre un acide ou une base forte ou faible avec l'eau
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
- Associer le caractère fort d’un acide (d’une base) à la transformation quasi-totale de cet acide (cette base) avec l’eau.
- Prévoir la composition finale d’une solution aqueuse de concentration donnée en acide fort ou faible apporté.
- Comparer la force de différents acides ou de différentes bases dans l’eau.
- Un acide fort AH est un acide qui réagit
totalement avec l’eau :
AH (aq) + H2O (l) → A– (aq) + H3O+ (aq). - Un acide faible AH réagit avec l’eau selon
une réaction limitée :
AH (aq) + H2O (l)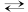 A– (aq) + H3O+ (aq).
A– (aq) + H3O+ (aq).
- Une base faible A– réagit
avec l’eau selon une réaction
limitée :
A– (aq) + H2O (l)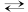 AH (aq) + HO– (aq).
AH (aq) + HO– (aq).
- Réaction acide-base, produit ionique de l’eau Ke, constante d’acidité KA
- Formule qui relie le pH et la concentration en
quantité de matière d’ions
oxonium :
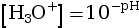
Soit un acide AH qui appartient au couple AH / A–. On considère la réaction de cet acide AH avec l’eau H2O. L’eau joue donc le rôle de base et appartient au couple H3O+ / H2O.
On utilise la flèche simple → pour préciser que la réaction est totale.
Cette propriété a une conséquence sur la composition finale de la solution : si on dissout n0 moles d’un acide fort AH dans l’eau, il va totalement être consommé par l’eau pour former n0 moles d’ions oxonium H3O+.
Voici le tableau d’avancement qui correspond.
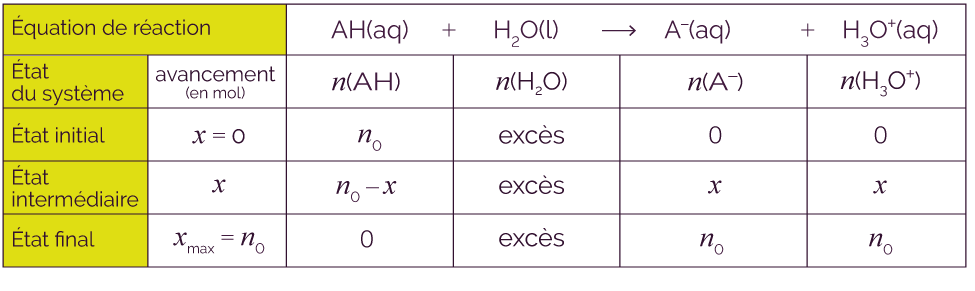
Acide chlorhydrique HCl, acide sulfurique H2SO4, acide nitrique HNO3.
Soit un acide AH qui appartient au couple AH / A–.
On utilise la double flèche ![]() pour préciser que la
réaction n’est pas totale.
pour préciser que la
réaction n’est pas totale.
Si la réaction de l’acide faible AH
avec l’eau n’est pas totale, cela veut dire
que la réaction AH (aq) + H2O (l) ![]() A– (aq) + H3O+ (aq)
a lieu dans les deux sens. Ainsi, la
base A– est
susceptible de réagir avec l’ion
oxonium H3O+ pour redonner
l’acide AH selon la réaction
inverse
A– (aq) + H3O+ (aq)
a lieu dans les deux sens. Ainsi, la
base A– est
susceptible de réagir avec l’ion
oxonium H3O+ pour redonner
l’acide AH selon la réaction
inverse
A– (aq) + H3O+ (aq) → AH (aq) + H2O (l).
Les deux réactions sont en compétition et vont progressivement mener à un état d’équilibre chimique. Si on dissout n0 moles d’un acide faible dans l’eau, il se formera xmax moles d’ions oxonium H3O+ et de base A–.
Voici le tableau d’avancement qui correspond.
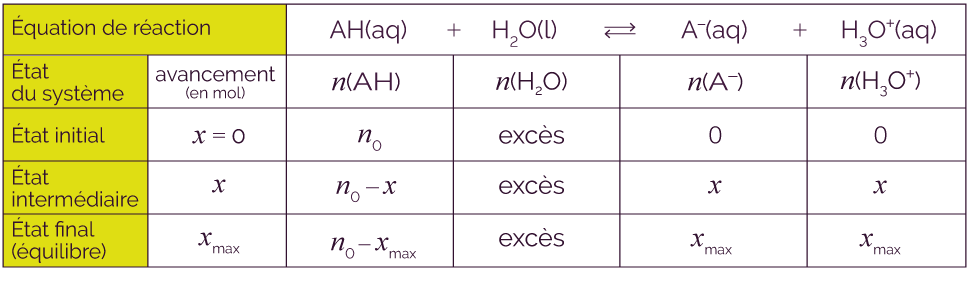
- Les acides carboxyliques (molécules qui possèdent le groupe caractéristique carboxyle –COOH) : acide éthanoïque CH3–COOH
- L’acide fluorhydrique HF
- L’ion ammonium NH
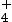
On fait réagir 1,5 × 10–2 mol d’acide propanoïque C2H5COOH avec l’eau. On mesure le pH de cette solution à l’équilibre, on trouve pH = 3,3. Le volume totale de la solution est de 250 mL.
Cet acide appartient au couple C2H5COOH / C2H5COO– et possède le groupe caractéristique carboxylique COOH, il est donc faible.
L’équation de sa réaction avec l’eau s’écrit :
C2H5COOH (aq) + H2O (l) ![]() C2H5COO– (aq) + H3O+ (aq)
C2H5COO– (aq) + H3O+ (aq)
On réalise le tableau d’avancement pour prévoir la composition finale de cette solution.
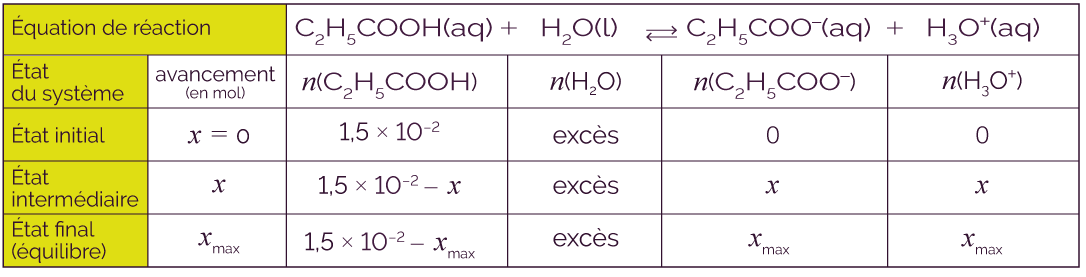
On sait que ![]() = 10–pH.
Or, ici
= 10–pH.
Or, ici ![]() .
.
On a donc ![]() = 10–pH
soit xmax=
V × 10–pH.
= 10–pH
soit xmax=
V × 10–pH.
Application numérique :
xmax = V × 10–pH = 0,250 × 10–3,3 = 1,3 × 10–4 mol.
On a donc :
![]() =
= ![]() = xmax
= xmax
![]() = 1,3 × 10–4 mol
= 1,3 × 10–4 mol
![]() = 1,5 × 10–2 – xmax= 1,5 × 10–2 – 1,3 × 10–4
= 1,5 × 10–2 – xmax= 1,5 × 10–2 – 1,3 × 10–4
![]() = 1,5 × 10–2 mol
= 1,5 × 10–2 mol
Soit une base A– qui appartient au couple AH / A–. On considère la réaction de cette base A– avec l’eau H2O. L’eau joue donc le rôle d’acide et appartient au couple H2O / HO–.
On utilise la flèche simple → pour préciser que la réaction est totale.
Cette propriété a une conséquence sur la composition finale de la solution : si on dissout n0 moles d’une base forte dans l’eau, elle va totalement être consommée par l’eau pour former n0 moles d’ions hydroxyde HO–.
Voici le tableau d’avancement qui correspond.
Hydroxyde de sodium (soude) NaOH, hydroxyde de potassium (potasse) KOH.
Soit une base A– qui appartient au couple AH / A–.
On utilise la double flèche ![]() pour préciser que la
réaction n’est pas totale.
pour préciser que la
réaction n’est pas totale.
Si la réaction de la base A– avec
l’eau n’est pas totale, cela veut dire que
la réaction A– (aq) + H2O (l) ![]() AH (aq) + HO– (aq) a
lieu dans les deux sens. Ainsi, l’acide AH
est susceptible de réagir avec l’ion
hydroxyde HO– pour
redonner sa base conjuguée A– selon la
réaction inverse AH (aq) + HO– (aq) → A– (aq) + H2O (l).
AH (aq) + HO– (aq) a
lieu dans les deux sens. Ainsi, l’acide AH
est susceptible de réagir avec l’ion
hydroxyde HO– pour
redonner sa base conjuguée A– selon la
réaction inverse AH (aq) + HO– (aq) → A– (aq) + H2O (l).
Les deux réactions sont en compétition et vont progressivement mener à un état d’équilibre chimique. Si on dissout n0 moles d’une base faible dans l’eau, il se formera xmax moles d’ion hydroxyde HO– et d’acide AH.
Voici le tableau d’avancement qui correspond.
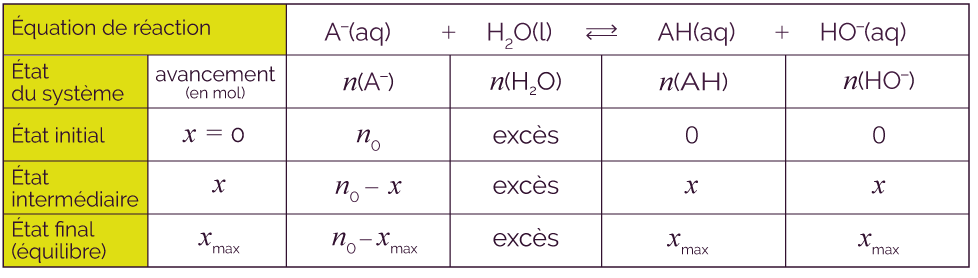
- Les ions carboxylates (molécules qui possèdent le groupe) –COO– : l’ion éthanoate CH3–COO–
- L’ammoniac NH3
On fait réagir, à 25 °C, 2,00 × 10–3 mol d’ammoniac NH3 avec l’eau. On mesure le pH de cette solution à l’équilibre, on trouve pH = 12,2. Le volume totale de la solution est de 100 mL.
Cette base appartient au couple NH![]() / NH3.
/ NH3.
L’équation de sa réaction avec l’eau n’est pas totale car c’est une base faible :
NH3 (aq) + H2O (l) ![]() NH
NH![]() (aq) + HO– (aq).
(aq) + HO– (aq).
On effectue le tableau d’avancement pour prévoir la composition finale de cette solution.
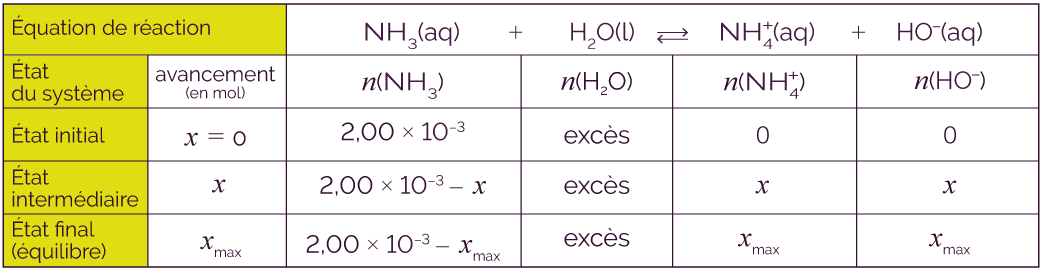
D’après ce tableau, on a ![]() . On utilise le produit ionique
de l’eau Ke pour
relier le pH et la concentration en ion hydroxyde.
. On utilise le produit ionique
de l’eau Ke pour
relier le pH et la concentration en ion hydroxyde.
À 25 °C, on a Ke = 10–14
![]() = 10–pH
= 10–pH
![]()
soit 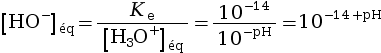 .
.
En combinant ces deux formules, on obtient :
![]() = 10–14+pH
soit xmax = V × 10–14+pH.
= 10–14+pH
soit xmax = V × 10–14+pH.
Application numérique :
xmax = V × 10–14+pH = 0,100 × 10–14+12,2 = 1,6 × 10–3 mol
On a donc :
![]() =
= ![]() = xmax
= xmax
![]() = 1,6 × 10–3 mol
= 1,6 × 10–3 mol
![]() = 2,00 × 10–3 – xmax = 2,00 × 10–3 – 1,6 × 10–3
= 2,00 × 10–3 – xmax = 2,00 × 10–3 – 1,6 × 10–3
![]() = 4,0 × 10–4 mol
= 4,0 × 10–4 mol
On considère deux acides AH1 et AH2 qui appartiennent aux couples A1H / A1– et A2H / A2–.
Ces deux acides réagissent avec l’eau selon les équations suivantes.
- A1H (aq) + H2O (l)
 A1– (aq) + H3O+ (aq),
constante d’acidité KA1
A1– (aq) + H3O+ (aq),
constante d’acidité KA1
- A2H (aq) + H2O (l)
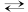 A2– (aq) + H3O+ (aq),
constante d’acidité KA2
A2– (aq) + H3O+ (aq),
constante d’acidité KA2
L’acide A2H va être plus fort que l’acide A1H si KA2 > KA1.
Plus la constante d’acidité d’un couple AH / A– est élevée et plus la réaction AH (aq) + H2O (l)
Plus un acide est consommé par l’eau et plus cet acide va être fort.
- Constante d’acidité à 25 °C d’un couple contenant un acide faible, l’acide méthanoïque HCOOH : KA = 6,8 × 10–4.
- Constante d’acidité à 25 °C d’un couple contenant un acide fort, l’acide chlorhydrique (H3O+ + Cl–) : KA = 1,0 × 107.
On considère deux bases A1– et A2– qui appartiennent aux couples A1H / A1– et A2H / A2–.
La base A2– va être plus forte que la base A1– si KA2 < KA1.

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








