Exploiter le diagramme de prédominance d'un couple acide-base
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
- Représenter le diagramme de prédominance d’un couple acide-base.
- Exploiter un diagramme de prédominance ou de distribution.
- Justifier le choix d’un indicateur coloré lors d’un titrage.
- La formule qui relie le pH et le pKA d’un
couple acide-base AH / A– est :
pH = pKA +
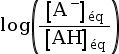 .
.
- Si pH < pKA, alors la forme acide AH est prédominante.
- Si pH = pKA, alors les deux formes sont prédominantes.
- Si pH > pKA, alors la forme basique A– est prédominante.
- Un indicateur est choisi pour un titrage avec suivi pH-métrique si sa zone de virage est comprise entre pH = pKA – 1 et pH = pKA + 1.
- Couple acide-base, pH, relation pH =
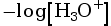
- Constante d’acidité d’un couple
acide-base :
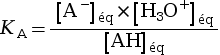
- Titrage avec suivi pH-métrique
- Propriétés et valeurs remarquables du
logarithme décimal, avec x et y des réels
strictement positifs :
- log 1 = 0 et log 10 = 1
- log(x × y) = log x + log y
- log xn = n × log x
-
log
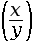 = log x – log y
= log x – log y
-
log
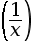 = –log x
= –log x
Pour un couple acide-base AH / A–, on appelle constante d’acidité la quantité KA.
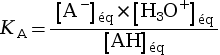
|
avec :
|
La constante d’acidité KA est
associée à un seul couple acide-base.
Elle ne dépend que de la température, qui
sera fixée à 25 °C. KA est
indépendante des conditions initiales,
c'est-à-dire de la concentration initiale en
acide faible dissous.
Plus une base est forte, plus sa constante d’acidité KA est faible.
pH = –log
On applique un logarithme décimal à
l’expression 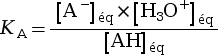 , ce qui donne :
, ce qui donne :
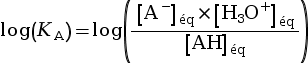
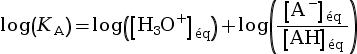 (car log(x × y) = log x + log y)
(car log(x × y) = log x + log y)
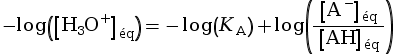
pH = pKA + 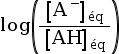 (car
pH = –log
(car
pH = –log![]() et pKA = –log(KA))
et pKA = –log(KA))
Il faut retenir la formule suivante qui relie le pH et le pKA.
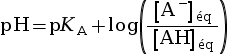
|
avec :
|
Plus un acide est fort, plus sa constante d’acidité KA est élevée. Or on sait que pKA = –log(KA).
De la même manière, plus une base est forte, plus sa constante d’acidité KA est faible et plus son pKA est élevé.
Le pKA est utilisé pour classer les couples acide-base. On se limite aux valeurs de pKA comprises entre 0 et 14.
On construit une échelle de pKA en positionnant à gauche de l’axe les acides et à droite les bases.
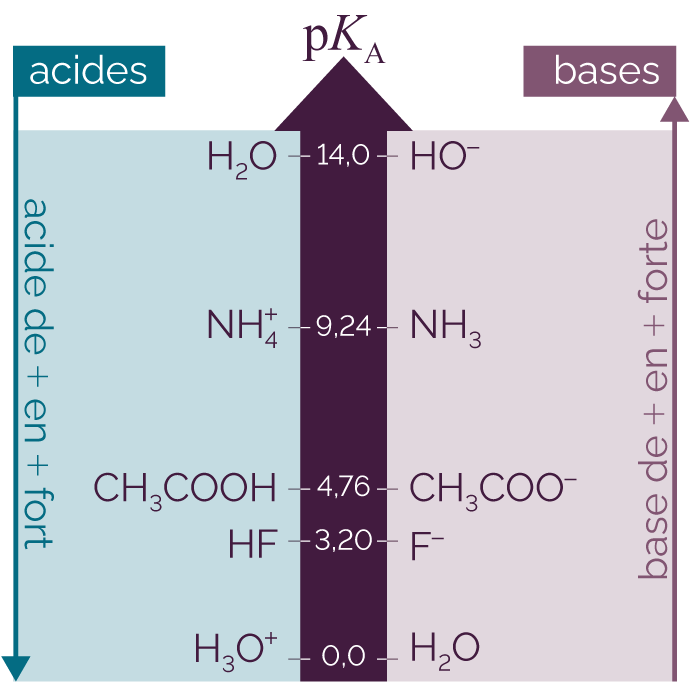
Échelle de pKA pour quelques couples acide-base
On retrouve bien qu’un acide est d’autant plus fort que son pKA est faible. Une base est d’autant plus forte que son pKA est fort.
D’après cette échelle de pKA :
- le couple NH
 /NH3 a un
pKA
égal à 9,24 ;
/NH3 a un
pKA
égal à 9,24 ;
- l’acide éthanoïque
CH3COOH est plus fort que l’ion
ammonium NH
 .
.
La constante d’acidité KA du couple H2O / HO– est égale au produit ionique de l’eau :
(car log xn = n × log x et log(10) = 1).
On retrouve le pKA du couple H2O / HO–.
On cherche à connaitre l’espèce prédominante entre un acide AH et sa base conjuguée A– en fonction du pH de la solution dans laquelle ils se trouvent.
On utilise pour cela la formule qui relie le pH et le pKA d’un couple :
pH = pKA + 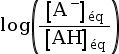
On peut voir les relations suivantes.
- Si pH < pKA,
alors
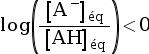 , soit
, soit 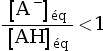 , donc :
, donc :
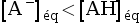 .
Explications :
.
Explications :
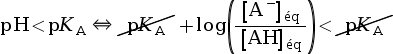
⇔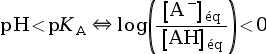
log(x) < 0 pour x < 1. - Si pH = pKA,
alors
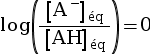 , soit
, soit 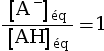 , donc :
, donc :
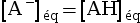 .
.
- Si pH > pKA,
alors
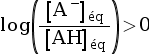 , soit
, soit 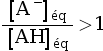 , donc :
, donc :
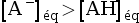 .
.
Le diagramme de prédominance d’un couple acide-base AH / A– représente la répartition des espèces acide AH et base A– selon le pH de la solution dans laquelle ils se trouvent.

Diagramme de pKA d’un couple acide-base
Connaissant le pH et le pKA d’un couple acide-base, on peut donc indiquer quelle forme domine entre l’acide AH ou la base A–.
On considère la réaction entre
l’acide éthanoïque CH3COOH
et l’eau H2O :
CH3COOH + H2O ![]() CH3COO– + H3O+.
CH3COO– + H3O+.
Au bout d’un certain temps, on mesure le pH de
cette solution et on trouve 5,8.
Pour déterminer l’espèce prédominante, on utilise le diagramme de prédominance du couple de l’acide éthanoïque.
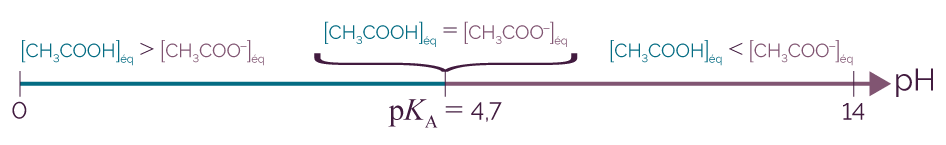
Diagramme de prédominance du couple CH3COOH / CH3COO–
On observe que le pKA du couple
CH3COOH / CH3COO–
vaut 4,7.
Or pH = 5,8 > 4,7.
L’espèce prédominante est donc
l’ion éthanoate
CH3COO–.
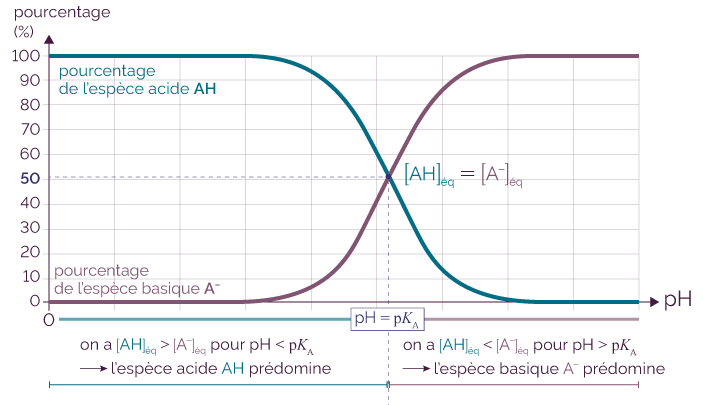
Diagramme de distribution d’un couple acide-base
Lorsque le pH = pKA, il y a dans la solution 50 % d’acide et 50 % de base.
On considère la réaction entre l’ammoniac NH3 et l’eau H2O :
NH3 + H2O ![]() NH
NH![]() + HO–.
+ HO–.
Au bout d’un certain temps, on mesure le pH de cette solution et on trouve 8,5.
Pour déterminer la répartition de l’acide et de la base de ce couple à ce pH, on utilise son diagramme de distribution.
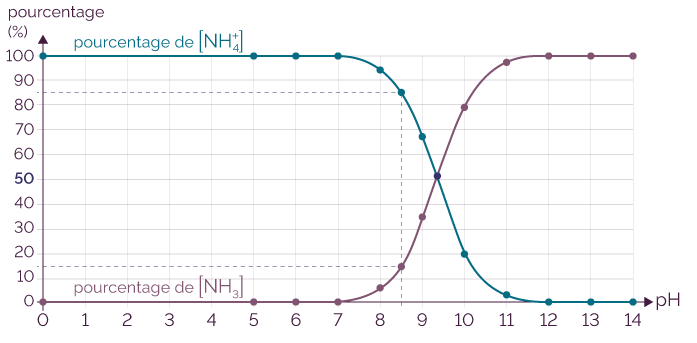
Diagramme de distribution du couple NH
On observe que pour un pH = 8,5, il y dans cette
solution 85 % d’ion ammonium NH![]() et 15 %
d’ammoniac NH3.
et 15 %
d’ammoniac NH3.
Un indicateur coloré est constitué d’une solution qui contient un acide faible, que l’on notera IndH et de sa base conjuguée, que l’on notera Ind–. La forme acide et la forme basique ont une teinte différente selon le pH de la solution.
Le couple d’un indicateur coloré IndH / Ind– est caractérisé par son pKA. Son diagramme de prédominance est le suivant.
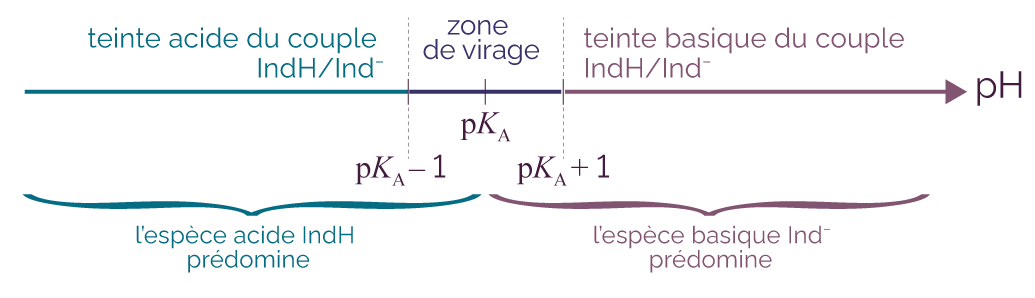
Diagramme de prédominance du couple IndH/Ind–
On observe que pour :
- pH < pKA – 1, c’est la forme acide IndH qui prédomine : la solution aura la teinte de la forme acide ;
- pH > pKA + 1, c’est la forme basique Ind– qui prédomine : la solution aura la teinte de la forme basique ;
- pKA – 1 < pH < pKA + 1, les deux formes sont présentes, la solution aura une teinte colorée intermédiaire entre sa teinte acide et sa teinte basique. Cette zone est appelée « zone de virage ».
On effectue le titrage d’une solution d’acide chlorhydrique qui contient l’acide H3O+ par une solution de soude qui contient la base HO–.
La courbe du titrage obtenue est la suivante.
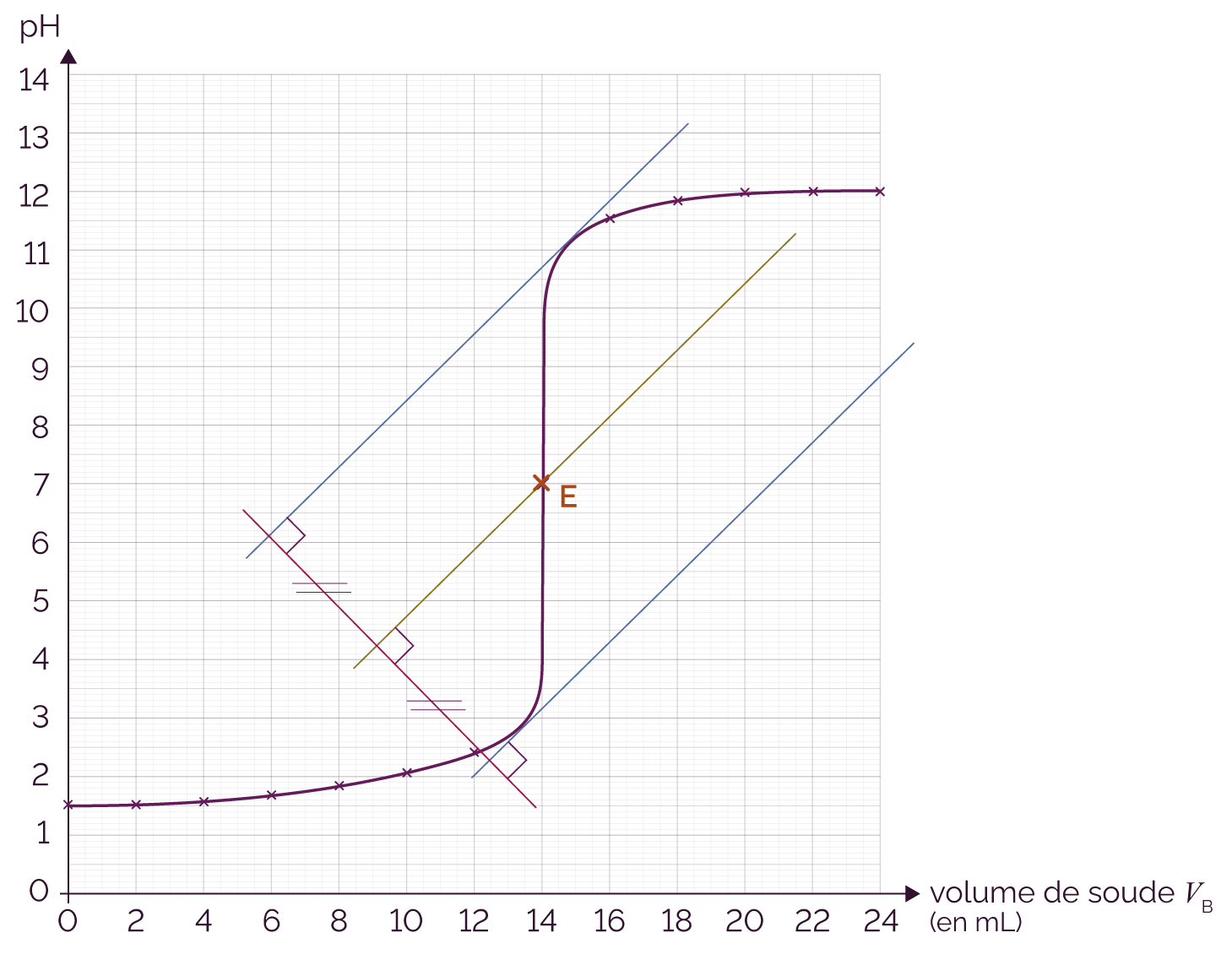
On souhaite trouver un indicateur coloré qui permettra de détecter visuellement l’équivalence. On remarque que le pH à l’équivalence de ce titrage est de 7. Il faut donc que l’indicateur coloré ait son compris entre 6 et 8.
On donne le pKA et la teinte des formes acides et basiques de 5 indicateurs colorés.

Caractéristiques de 5 indicateurs colorés
L’indicateur qui correspond pour ce titrage est le bleu de bromothymol car son pKA est égal à 6,8 qui est bien compris entre 6 et 8.

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








