Étudier le fonctionnement d'une pile
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
- Modéliser et schématiser le fonctionnement d’une pile.
- Déterminer la capacité électrique d’une pile à partir de sa constitution initiale.
- Une pile est constituée de deux demi-piles qui sont des cellules contenant un couple oxydant-réducteur.
- Il s’agit le plus souvent d’une plaque métallique (appelée électrode) constituée d’un métal M, qui plonge dans une solution aqueuse contenant l’ion métallique Mn+. Le couple oxydant-réducteur est alors Mn+ (aq) / M (s). Les deux demi-piles sont reliées par un pont salin qui assure la conduction électrique dans la pile.
- Une pile convertit de l’énergie chimique en énergie électrique, qu’elle fournit à un circuit extérieur branché entre ses deux électrodes.
- Une réaction électrochimique a lieu à la borne négative : c’est une oxydation. Les électrons sont cédés par le réducteur métallique et sont transférés dans le circuit extérieur.
- Une réaction électrochimique a lieu à la borne positive : c’est une réduction. Les électrons venant du circuit extérieur sont captés par l’oxydant.
- L’équation de la réaction de fonctionnement de la pile correspond à la combinaison des deux réactions électrochimiques.
- La capacité électrique d’une pile est égale à la charge électrique maximale que la pile peut fournir durant toute sa durée de fonctionnement.
- Concentration en quantité de matière
- Réaction d’oxydoréduction
- Tension électrique, électrons, courant électrique
La plaque métallique est appelée électrode.

Illustration d’une demi-pile
Le métal M et l’ion
métallique Mn+ constituent le
couple oxydant-réducteur Mn+ (aq) / M (s).
Ils sont reliés par la demi-équation
électronique suivante.
Mn+ (aq) + n × e– ![]() M (s)
M (s)
Le réducteur M (s) cède n électrons tandis que l’oxydant Mn+ (aq) les capte.
Le métal M est un métal qui doit être très réducteur, c’est-à-dire qu’il cède facilement des électrons.
| Métal | Ion métallique | Demi-équation |
| Cu (s) | Cu2+ (aq) |
Cu2+ (aq) + 2 × e– |
| Zn (s) | Zn2+ (aq) |
Zn2+ (aq) + 2 × e– |
| Ag (s) | Ag+ (aq) |
Ag+ (aq) + e– |
Il existe des demi-piles où l’oxydant et le réducteur sont en solution aqueuse. Dans ce cas, l’électrode est en graphite (carbone pur) ou en platine, qui est chimiquement inerte (elle ne réagit pas).
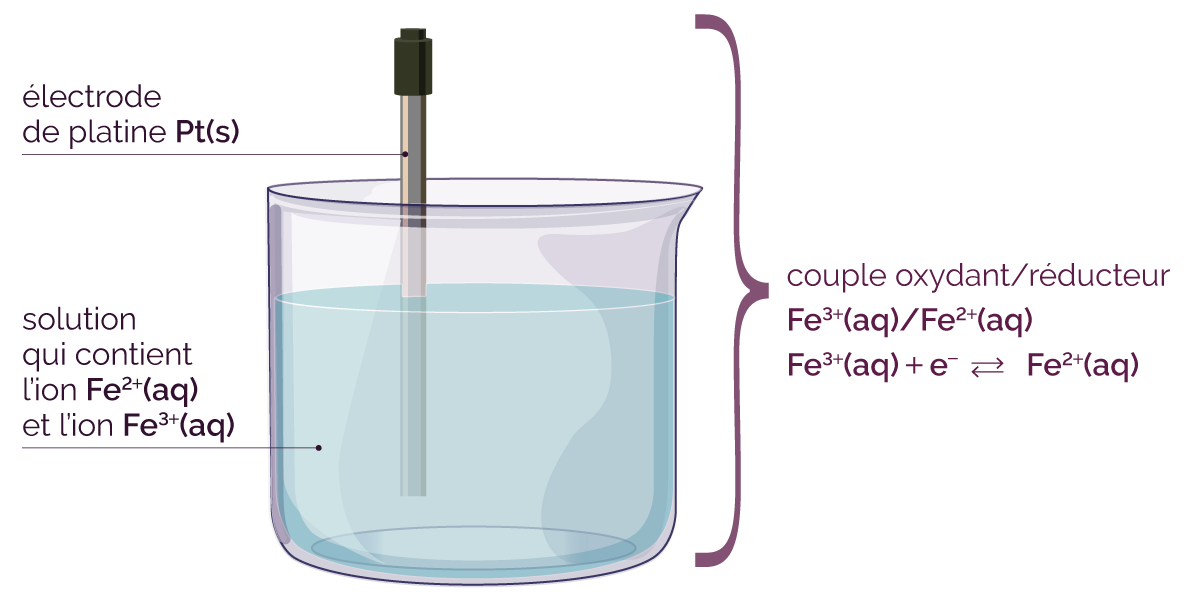
Illustration d’une demi-pile
avec une électrode en platine
Le pont salin est généralement un tube en forme de U qui contient une solution aqueuse gélifiée ionique. Les ions du pont salin ne participent pas aux réactions chimiques ayant lieu dans la pile.
Le pont salin peut aussi être un morceau de papier filtre imbibé d’une solution ionique.

Pile zinc Zn (s) – cuivre Cu (s)
Les ions généralement présents dans le pont salin sont les suivants.
| Cation |
Ammonium NH |
Potassium K+ |
| Anion |
Nitrate NO |
Chlorure Cl– |
Ces ions sont dits inertes chimiquement car ils ne réagissent pas avec les entités chimiques présentes dans les demi-piles.
Lors de son fonctionnement, la pile fournit à un circuit extérieur un courant électrique. Ce courant est créé grâce à des réactions électrochimiques ayant lieu au niveau des électrodes de la pile.
À une des électrodes, des électrons sont formés et partent dans le circuit ; à l’autre électrode, des électrons en provenance du circuit sont consommés.
À l’électrode positive, appelée la cathode, les électrons sont consommés au cours d’une réaction électrochimique du type :
M1![]() (aq) +
n1× e– →
M1 (s)
(aq) +
n1× e– →
M1 (s)
Il s’agit d’une
réduction : l’ion
métallique M1![]() est réduit en captant les
électrons.
est réduit en captant les
électrons.
À l’électrode négative, appelée l’anode, les électrons sont formés au cours d’une réaction électrochimique du type :
M2 (s) → M2![]() (aq) + n2 × e–
(aq) + n2 × e–
Il s’agit d’une oxydation : le métal M2 est oxydé en cédant les électrons.
L’équation de fonctionnement de la pile est obtenue en combinant les deux équations électrochimiques aux électrodes.
|
M1 |
× n2 |
|
M2 (s) → M2 |
× n1 |
On multiplie chacune des équations électrochimiques par un nombre de telle sorte que le nombre d’électrons échangés entre les deux électrodes soit le même.
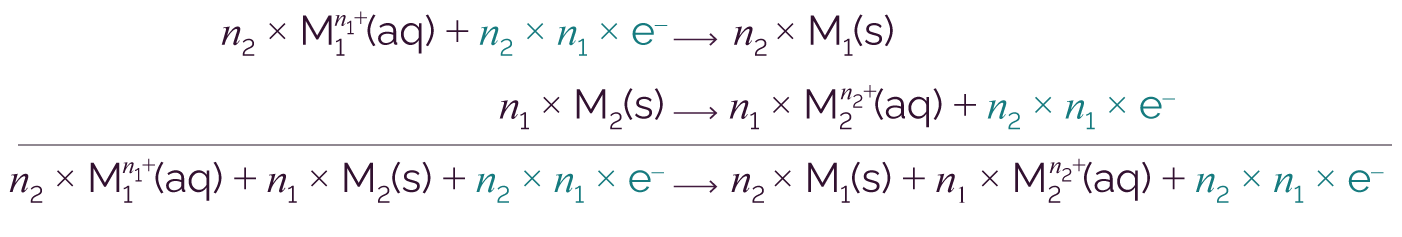
On simplifie à gauche et à droite de la flèche les électrons et on obtient l’équation de fonctionnement.
n2 × M1![]() (aq) + n1 ×
M2 (s) → n2 ×
M1 (s) +
n1 ×
M2
(aq) + n1 ×
M2 (s) → n2 ×
M1 (s) +
n1 ×
M2![]() (aq)
(aq)
Les électrons et les anions circulent dans le sens opposé à celui du courant électrique, et les cations circulent dans le même sens.

Circulation des charges à l’extérieur
et à l’intérieur de la pile zinc-cuivre
Dans un métal, le courant est constitué par les électrons ; dans une solution aqueuse (ou un gel ionique), le courant est constitué par le double déplacement des anions et des cations.
Le pont salin a un double rôle.
- Il permet d’assurer le passage du courant dans la pile.
- Il permet d’assurer l’électroneutralité des solutions aqueuses de chaque demi-pile.

Illustration du double rôle du pont salin
dans la pile zinc-cuivre
Lorsque la pile ne débite pas de courant, la mesure de la tension électrique entre ses deux électrodes (à l’aide d’un voltmètre) nous permet d’obtenir sa tension à vide.

Mesure de la tension à vide de la pile zinc-cuivre
Un voltmètre possède deux bornes de branchement : une borne notée V et une borne notée COM. La mesure se fait en branchant le voltmètre en dérivation entre les deux points où l’on veut obtenir la tension électrique.
Le signe de la tension mesurée nous permet de trouver la polarité de la pile, c’est-à-dire les signes respectifs de chacune des électrodes qui constituent les bornes de la pile.
| Signe de la tension mesurée |
Signe de
l’électrode reliée à V |
Signe de
l’électrode reliée à COM |
| Positif | Positif | Négatif |
| Négatif | Négatif | Positif |
Cette capacité a comme unité le coulomb (C), qui est l’unité de la charge électrique.
La capacité électrique Qmax est proportionnelle à la quantité maximale d’électrons nmax(e–) que peut faire circuler une pile durant toute sa durée de vie.
| Qmax = nmax(e–) × e × NA |
avec :
|
La constitution initiale de la pile zinc-cuivre est donnée sur le schéma suivant.

L’équation de fonctionnement de la pile est la suivante.
Cu2+ (aq) + Zn (s) → Cu (s) + Zn2+ (aq)
On cherche le réactif limitant en calculant les quantités initiales d’ion cuivre II et de métal zinc.
ni![]() =
= ![]() × V = 0,20 × 0,100 = 2,0 × 10–2 mol
× V = 0,20 × 0,100 = 2,0 × 10–2 mol
ni![]() = 3,1 × 10–1 mol
= 3,1 × 10–1 mol
On constate que 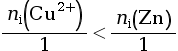 .
.
On en déduit que l’ion cuivre (II) est le
réactif limitant.
L’équation électrochimique à la cathode s’écrit :
Cu2+ (aq) + 2 e– → Cu (s)
On a alors la relation suivante.
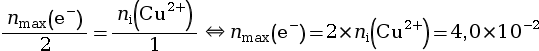 mol
mol
On calcule la capacité Qmax de cette
pile.
Qmax = nmax(e–) × e × NA
Qmax = 4,0 × 10–2 × 1,60 × 10–19 × 6,02 × 1023
Qmax = 3,9 × 103 C

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








