Identifier un intermédiaire réactionnel et un catalyseur dans un mécanisme réactionnel
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
- À partir d’un mécanisme réactionnel fourni, identifier un intermédiaire réactionnel, un catalyseur et établir l’équation de la réaction qu’il modélise au niveau microscopique.
- Représenter les flèches courbes d’un acte élémentaire, en justifiant leur sens.
- Un acte élémentaire est une réaction qui se réalise en une seule étape et qui fait intervenir une ou deux molécules au maximum.
- Le transfert des électrons au cours de ces actes est représenté par des flèches courbes qui vont de la position initiale à la position finale.
- À chaque réaction chimique est associée un mécanisme réactionnel qui correspond à la succession des actes élémentaires faisant passer des réactifs aux produits.
- Un intermédiaire réactionnel est une entité qui apparait à l’issue d’un acte élémentaire puis qui est consommé au cours d’un acte élémentaire suivant. Il s’agit souvent de carbocations qui sont des espèces très réactives et instables.
- Un catalyseur est une entité chimique qui a pour effet d’accélérer une réaction chimique. Sa présence modifie le mécanisme réactionnel. Il est consommé au cours d’un acte élémentaire et est régénéré dans un suivant. Le catalyseur n’apparait pas dans l’équation bilan de la réaction chimique.
Réaction chimique : réactif, produit, catalyseur
L’équation d’une réaction chimique est un bilan quantitatif de la transformation des réactifs aux produits. Le déroulement réel d’une transformation chimique nous est fourni par son mécanisme réactionnel qui fait intervenir des actes élémentaires.
Le transfert des électrons au cours d’un acte élémentaire est modélisé par une flèche courbe : elle symbolise le déplacement d’un doublet d’électrons. Cette flèche a pour origine la localisation initiale du doublet et pointe sur sa localisation finale.
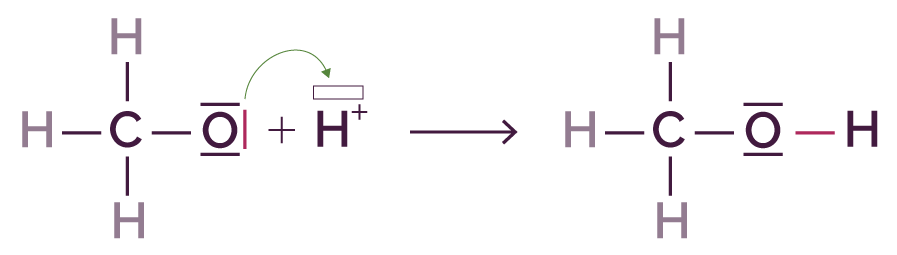
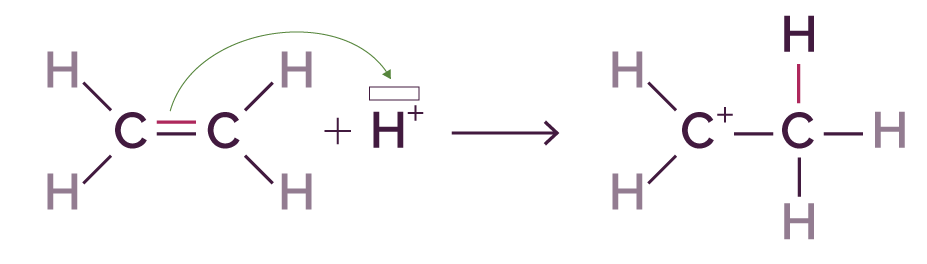
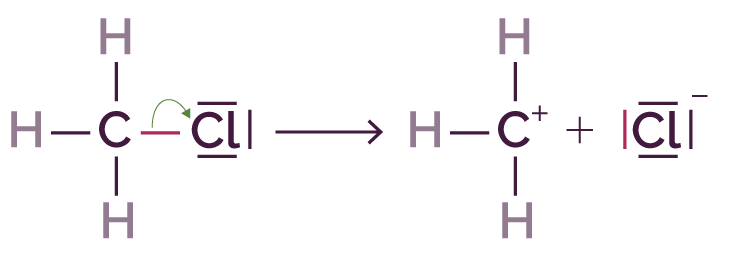
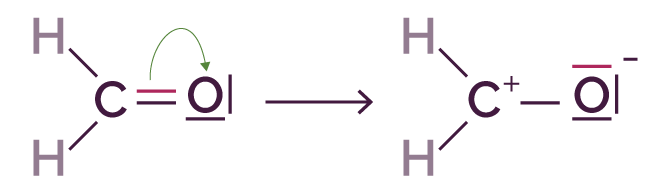
- La formation d’une liaison ou d’un doublet non liant peut se faire par la rupture d’une des liaisons d’une double liaison.
- Un acte élémentaire peut-être
associé à une simple flèche
entre réactifs et
produits (→),
ce qui signifie que la réaction se fait
totalement dans le sens indiqué par la
flèche, ou elle peut être
associée à une double
flèche (
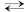 ), ce qui signifie
que la réaction peut se faire dans un sens
ou dans l’autre.
), ce qui signifie
que la réaction peut se faire dans un sens
ou dans l’autre.
Chaque acte élémentaire représente une étape du mécanisme réactionnel.
On considère la réaction chimique entre l’éthanal C2H4O et l’ammoniac NH3.
L’équation chimique est la suivante.
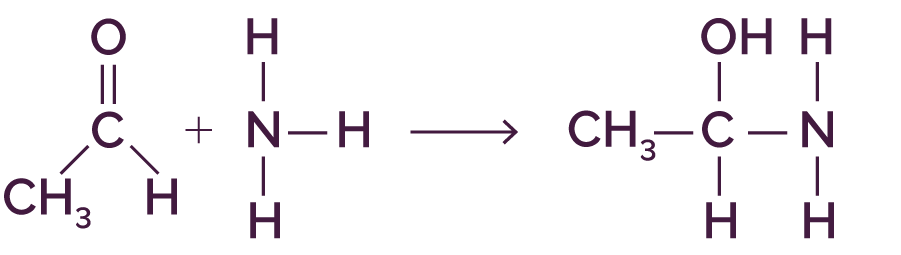
Le mécanisme réactionnel associé est le suivant.
Ce mécanisme réactionnel est constitué de deux actes élémentaires.
Dans un mécanisme réactionnel, on peut identifier des intermédiaires réactionnels et des catalyseurs.
Cet intermédiaire est souvent un carbocation : c’est une entité chimique avec un atome de carbone qui possède une charge positive.
On peut aussi trouver d’autres entités chimiques telles que celles avec un atome d’azote ou d’oxygène qui portent une charge positive.
Ces entités sont très instables et réagissent donc rapidement.
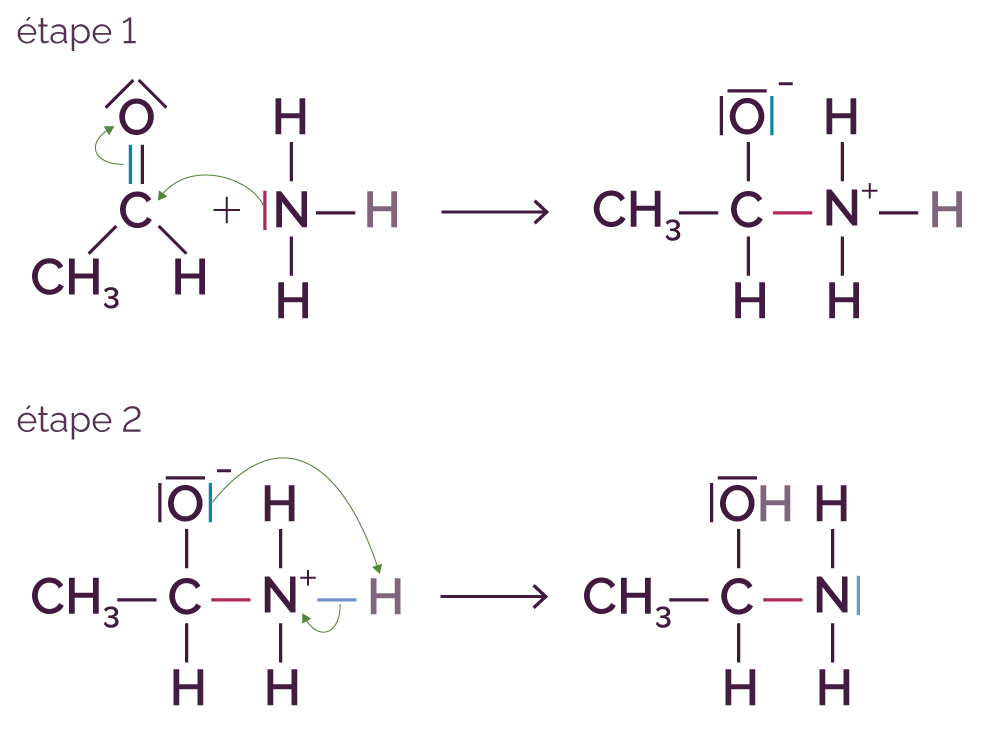
La réaction entre le 2-méthylprop-1-ène et le bromure d’hydrogène a l’équation chimique suivante.
Son mécanisme réactionnel comporte deux étapes (donc deux actes élémentaires successifs).
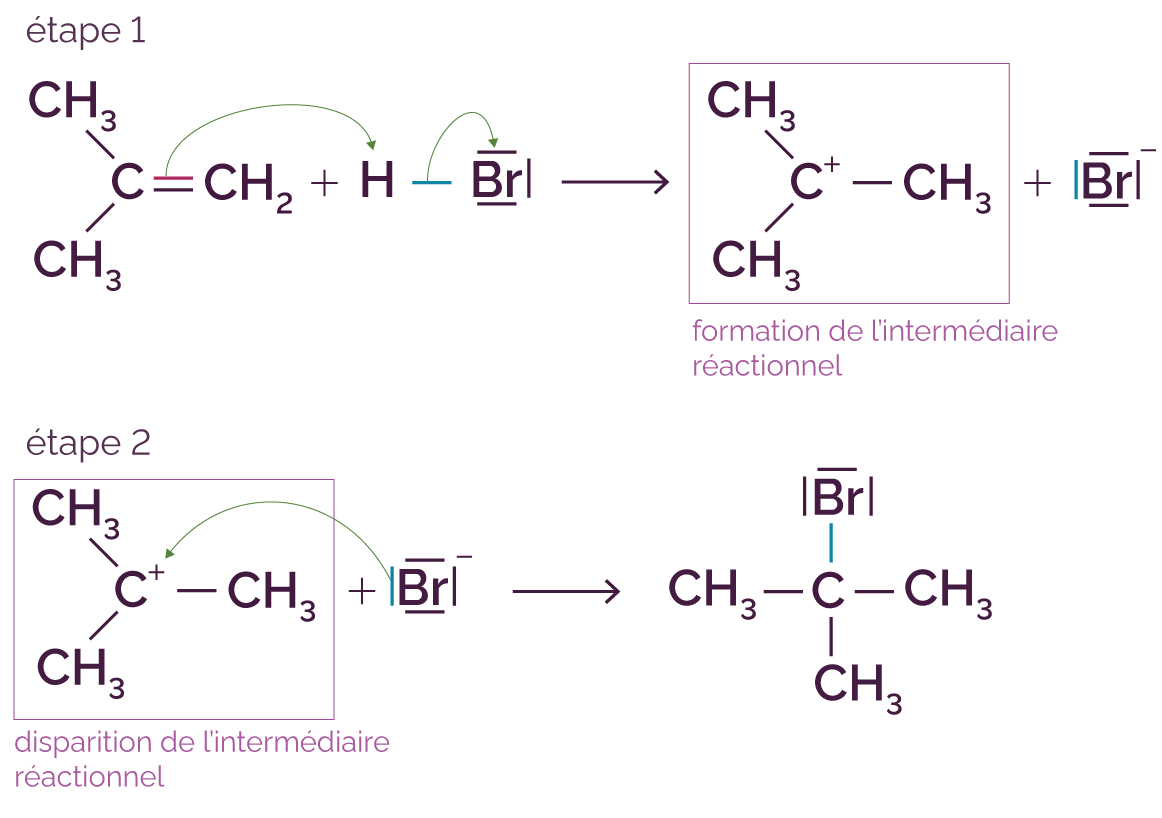
Dans cet exemple, l’intermédiaire réactionnel est un carbocation.
Le catalyseur est consommé lors d’un acte élémentaire, puis est régénéré lors d’un acte élémentaire suivant : il n’apparait donc pas dans l’équation de la réaction.
Le benzène C6H6
réagit avec l’acide
nitrique HNO3 en présence
d’acide sulfurique H2SO4.
L’équation de la réaction chimique
est la suivante.
C6H6 + HNO3 → C6H5NO2 + H2O
Le mécanisme réactionnel est le suivant.
Étape 1 : H2SO4 + HNO3 ![]() HSO
HSO![]() + H2NO
+ H2NO![]() (consommation
de H2SO4)
(consommation
de H2SO4)
Étape 2 : H2NO![]()
![]() NO
NO![]() + H2O
+ H2O
Étape 3 : C6H6 + NO![]() → C6H6NO
→ C6H6NO![]()
Étape 4 :
C6H6NO![]() + HSO
+ HSO![]() → C6H5NO2 + H2SO4
(régénération
de H2SO4)
→ C6H5NO2 + H2SO4
(régénération
de H2SO4)
L’acide sulfurique H2SO4 n’apparait pas dans l’équation de la réaction, il est consommé au cours d’un acte élémentaire puis régénéré au cours d’un autre : il joue le rôle de catalyseur.

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








