Étudier des facteurs cinétiques
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
Étudier expérimentalement des facteurs cinétiques.
- Étudier l’évolution temporelle de systèmes chimiques siège d’une réaction chimique lente (dont la durée varie de quelques secondes à quelques minutes) consiste à suivre la variation dans le temps des quantités de matière des réactifs et des produits.
- Des études expérimentales permettent de
mettre en évidence le rôle joué par des
facteurs cinétiques tels que la température
ou la concentration initiale des réactifs, ou alors
par un catalyseur.
On peut le faire lorsque les réactifs ou les produits sont des espèces colorées, ou à l’aide d’appareils de mesure (pressiomètre, spectrophotomètre, etc.), qui permettent ensuite de trouver l’évolution temporelle des quantités de matière (ou des concentrations) des réactifs et des produits.
- Facteurs cinétiques
- Réaction chimique
- Absorbance et loi de Beer-Lambert
Une étude expérimentale permet de mettre en évidence l’influence des facteurs cinétiques tels que la température ou la concentration des réactifs sur la rapidité de la transformation chimique, en réalisant une étude spectrophotométrique lorsqu’une des espèces est colorée.
L’absorbance A est une grandeur sans unité, mesurée par un spectrophotomètre, qui est liée à la proportion de lumière absorbée par une solution colorée.
On considère une cuve spectrophotométrique traversée par une lumière monochromatique, c’est-à-dire composée d’une seule radiation de longueur d’onde. Dans cette cuve se trouve une solution aqueuse qui contient une espèce chimique colorée de concentration en quantité de matière C.
 Spectrophotomètre |
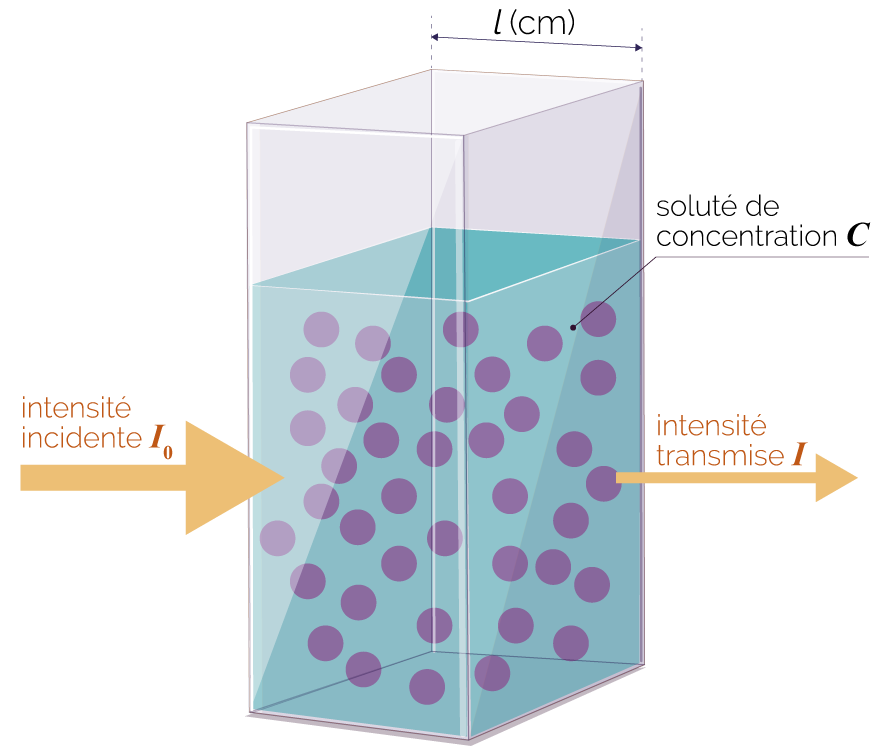 Cuve pour spectrophotomètre |
La mesure de l’absorbance A conduit à deux conclusions.
- L’absorbance dépend de la longueur d’onde λ de la radiation qui traverse la solution colorée. L’espèce chimique absorbe plus ou moins la radiation en fonction de sa longueur d’onde.
- L’absorbance A est proportionnelle à la concentration en quantité de matière C de l’espèce chimique colorée.
La relation entre A et C est fournie par la loi de Beer-Lambert.
| A = k × C |
avec :
|
La constante k dépend de la longueur d’onde λ de la radiation choisie et de l’épaisseur l de la cuve spectrophotométrique.
Une fois l’absorbance A mesurée, on trouve la concentration en quantité de matière C de l’espèce colorée en appliquant la loi de Beer-Lambert.
![]()
La loi de Beer-Lambert n’est valable que pour un domaine en concentrations faibles où celles-ci sont inférieures ou égales à
On réalise la transformation chimique en solution aqueuse, au cours de laquelle l’ion iodure I– réagit avec la molécule d’eau oxygénée H2O2. Il se forme du diiode I2 et de l’eau.
Le diiode est la seule espèce colorée, les autres sont incolores. Le diiode donne une coloration jaune à la solution dans laquelle il se trouve dissous. Cette coloration vire du jaune au brun lorsque sa concentration augmente. Cette réaction est lente.
L’équation de la réaction chimique est la suivante.
2 I– (aq) + H2O2 (aq) + 2 H+ (aq) → I2 (aq) + 2 H2O (l)
Afin de tester l’influence de la température sur la rapidité de la réaction, on réalise trois expériences telles que le système chimique initial soit le même, à des températures différentes.
| Expérience |
[I–]initial (en mol·L–1) |
[H2O2]initial (en mol·L–1) |
Température (en °C) |
| n°1 | 1,0 × 10–2 | 5,0 × 10–2 | 10 |
| n°2 | 1,0 × 10–2 | 5,0 × 10–2 | 20 |
| n°3 | 1,0 × 10–2 | 5,0 × 10–2 | 40 |
Le mélange des réactifs se fait dans un tube à essai plongé dans un bain d’eau thermostaté à la température fixée.
On prend des photographies au cours de la réaction pour les trois expériences.
| Expérience | t = 0 s | t = 5 s | t = 10 s | t = 15 s |
| n°1 (10 °C) |

|

|

|

|
| n°2 (20 °C) |

|

|

|

|
| n°3 (40 °C) |

|

|

|

|
On observe que l’intensité de la coloration du fait de la formation du diiode évolue plus rapidement lorsque la température du milieu réactionnel est grande.
Cela nous permet de conclure que la réaction chimique évolue d’autant plus vite que la valeur de la température du milieu réactionnel est grande.
On peut estimer la durée de la réaction Δtréaction entre l’ion iodure et l’eau oxygénée à partir de la courbe de l’évolution de la concentration en quantité de matière de diiode formé.
Un spectrophotomètre mesure l’absorbance A de la solution qui est proportionnelle à la concentration [I2] en diiode formé. Comme le diiode est la seule espèce chimique colorée, la loi de Beer-Lambert indique en effet que l’absorbance A est proportionnelle à la concentration en quantité de matière de l’unique espèce chimique colorée.
|
A = k × [I2] |
avec :
|
On relève à intervalles de temps réguliers la valeur de l’absorbance A, ce qui permet de tracer l’évolution temporelle de la concentration en quantité de matière de diiode [I2].
On réalise ceci pour les trois expériences décrites précédemment et on donne les courbes [I2] = f (t).
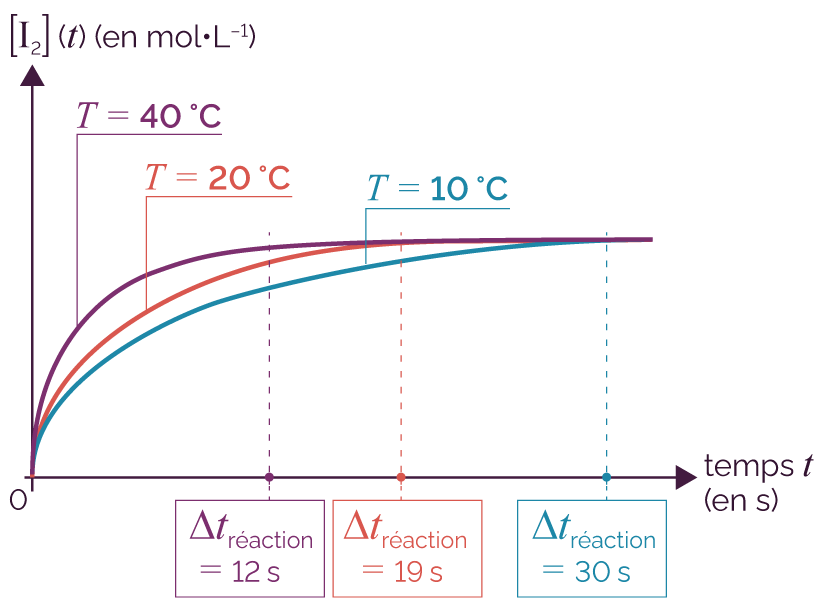
Courbes d’évolution temporelle
de la concentration du diiode
On détermine la durée de la réaction Δtréaction en identifiant l’instant à partir duquel la concentration en quantité de matière du diiode formé n’évolue plus dans le temps. La réaction est alors achevée.
L’analyse des courbes nous montre que la durée de réaction diminue au fur et à mesure que la température du milieu réactionnel est grande : la réaction entre l’ion iodure et l’eau oxygénée est donc d’autant plus rapide que la température est grande.

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








