Réaliser un titrage avec suivi conductimétrique
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
- Mettre en œuvre le suivi conductimétrique d’un titrage.
- Exploiter un titrage avec suivi
conductimétrique :
- en justifiant qualitativement l’évolution de la pente de la courbe à l’aide de données sur les conductivités ioniques molaires ;
- en déterminant une concentration en quantité de matière.
- La loi de Kohlrausch indique que la conductivité σ (en S·m–1) d’une solution ionique diluée s’écrit σ = λA × [A] + λB × [B] + λC × [C] + …
- Pour titrer une espèce chimique A, on verse
progressivement une espèce chimique
titrante B.
La réaction a × A + b × B → c × C + d × D est la réaction support du titrage.
Lors d’un titrage par conductimétrie, on suit l’évolution de la conductance de la solution A en fonction du volume VB de solution B versé. - À l’équivalence, la
conductivité est minimale : on trouve alors le
volume VB(éq)
correspondant. La relation à
l’équivalence
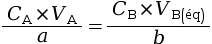 donne ensuite la
concentration CA de
l’espèce chimique A.
donne ensuite la
concentration CA de
l’espèce chimique A.
- Conductance, conductivité ; loi de Kohlrausch
- Titrage, quantité de matière
- Formule
Une solution qui contient des ions conduit le courant.
La conductivité s’exprime en siemens par mètre (S·m–1).
Il est possible d’avoir accès à la conductivité σ d’une solution en utilisant un conductimètre qui mesure la conductance G d’une solution. La conductance G, qui s’exprime en siemens (S), est en effet proportionnelle à la conductivité σ de la solution.
Pour des solutions ioniques, la loi de Kohlrausch montre que la conductivité σ de la solution est proportionnelle à la concentration C du solide ionique dissous : σ = k × C.
Si ce solide résulte de la dissolution de plusieurs ions en solutions A, B, C, etc., alors la conductivité de cette solution s’exprime par la relation suivante.
| σ = λA × [A] + λB × [B] + λC × [C] + … |
avec :
|
La conductivité σ va donc dépendre des espèces ioniques en solution.
On garde en tête que la conductance est proportionnelle à la conductivité σ, donc à λA × [A] + λB × [B] + λC × [C] + …
La finalité d’un titrage conductimétrique est de déterminer la concentration CA d’une espèce A en solution en faisant réagir deux solutions entre elles :
- une solution SA contenant une espèce A de concentration CA inconnue (solution titrée) ;
- une solution SB contenant une espèce B de concentration CB connue (solution titrante).
Au cours de ce titrage, on étudie la variation de la conductance G de la solution titrée au fur et à mesure que la solution titrante de concentration connue est versée.
L’ajout de la solution SB dans la solution SA va entrainer une modification de la valeur de la conductance de la solution, notamment par la consommation progressive de l’espèce A par l’espèce B.
La conductance mesurée diminue jusqu’à l’équivalence où elle présente un minimum, puis ré-augmente si on continue à verser la solution SB.
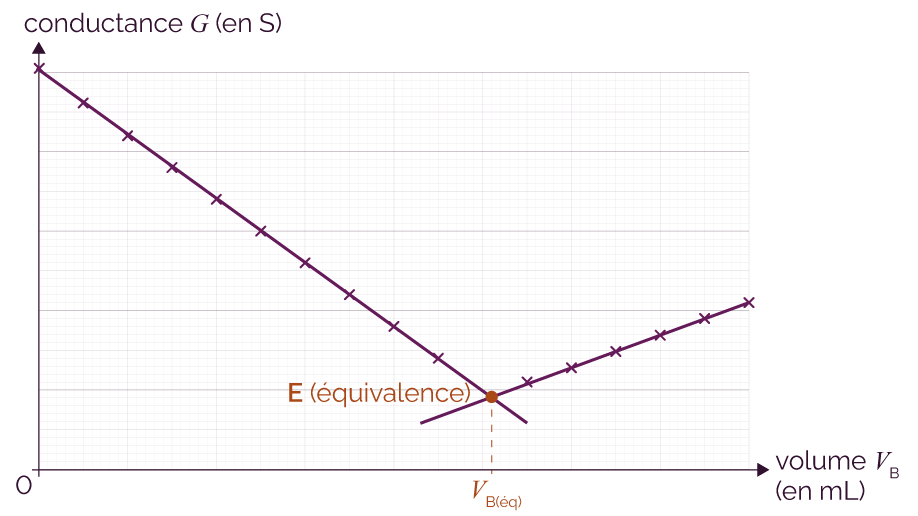
Dans certaines réactions (moins courantes), la conductance G de la solution augmente jusqu’à l’équivalence puis diminue ensuite. Cela va dépendre des ions en solution.
Le titrage d’une solution nécessite l’utilisation du matériel de chimie suivant.
- Bécher
- Burette graduée
- Agitateur magnétique + barreau aimanté
- Support pour la burette graduée
- Pipette jaugée + pipeteur
- Eau distillée
- Conductimètre
Le titrage nécessite deux solutions : une titrée et une titrante.
La solution SA contient une
espèce A de concentration en quantité de
matière CA (en
mol·L–1)
: c’est la concentration du réactif
titré A.
La concentration CA est
inconnue et on cherche à l’estimer. Cette
solution a pour volume VA
(en L) : c’est le volume fixe de la
solution titrée au début de la
manipulation, qui se trouve dans le bécher.
La solution SB contient une
espèce B de concentration en quantité de
matière CB
(en mol·L–1) :
c’est la concentration de réactif titrant
B.
La concentration CB doit
être connue avec précision. Cette solution
a pour volume VB (en L) :
c’est le volume de réactif titrant
qu’on va ajouter progressivement dans le
bécher.
Pour réaliser un titrage avec suivi conductimétrique, il faut réaliser les étapes suivantes.
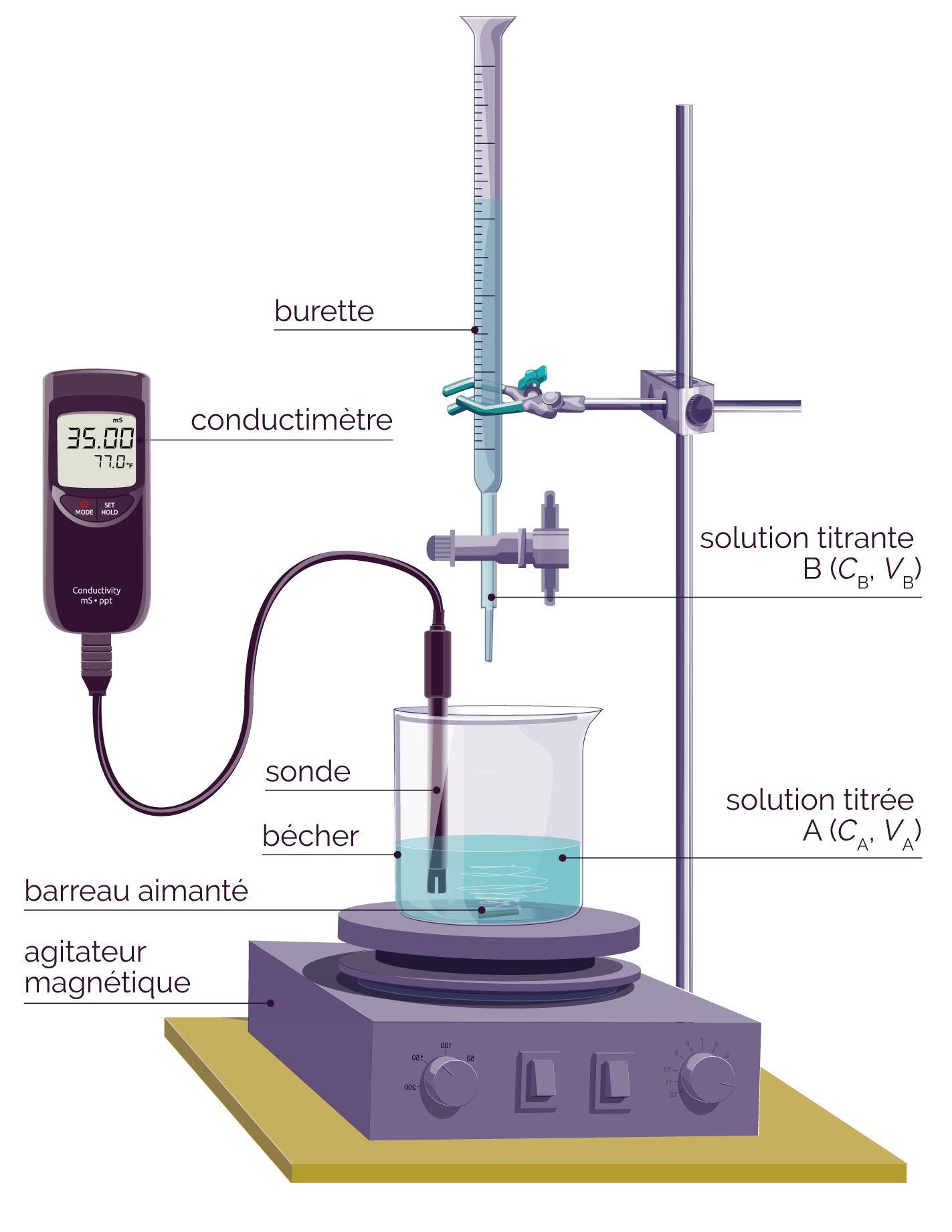
Schéma du titrage
On verse la solution titrante SB dans la burette graduée.
Le volume VA de la solution titrante SA doit être précis. On le prélève à l’aide d’une pipette jaugée et d’un pipeteur. On l’introduit ensuite dans le bécher.
- On met en route l’agitateur magnétique et on allume le conductimètre.
- On fait ensuite réagir la
solution SB contenue dans la burette
(réactif titrant) avec la
solution SA contenue dans le
bécher (réactif titré).
- On introduit pour cela le réactif titrant B dans le bécher par paliers de 1 mL, en ouvrant légèrement le robinet de la burette.
- Pour chaque volume versé, on note la valeur de la conductance de la solution située dans le bécher en prenant soin d’attendre que la valeur se stabilise.
- On trace ensuite la courbe de la conductance G en fonction du volume de la solution B versée.
Lorsque les solutions SA et SB entrent en contact, il se produit une réaction chimique, qui est le support du titrage : le réactif A (contenu dans la solution SA) réagit avec le réactif B (contenu dans la solution SB) pour former deux produits : C et D.
La réaction s’écrit de la manière suivante.
| a × A + b × B → c × C + d × D |
| où a, b, c et d sont les coefficients stœchiométriques des éléments respectifs A, B, C et D. |
À l’équivalence, les
espèces A et B sont introduites en
proportions stœchiométriques. Les
quantités de matière des deux
espèces A et B vérifient la
relation : ![]() .
.
En notant VB(éq) le volume de l’espèce B versé à l’équivalence, on a la relation suivante.
|
|
avec :
|
Cette relation permet d’obtenir la concentration CA recherchée :
![]() .
.
Pour estimer CA, il faut déterminer VB(éq), c'est-à-dire détecter l’équivalence. Le point d’équivalence a lieu au changement de pente et a pour abscisse VB(éq).
On titre une solution d’acide chlorhydrique (H3O+ (aq) + Cl– (aq)) de concentration CA inconnue et de volume par une solution de soude (Na+ (aq) + HO– (aq)) de concentration CB = 5,0 × 10–3 mol·L–1.
La réaction support de ce titrage est la suivante :
H3O+ (aq) + HO– (aq) → 2 H2O (l)
Les ions Na+ et Cl– sont des ions spectateurs car ils ne participent pas à cette réaction.
On procède au titrage par conductimétrie et on obtient le graphe suivant qui représente la conductance G de la solution en fonction du volume de soude versé VB.
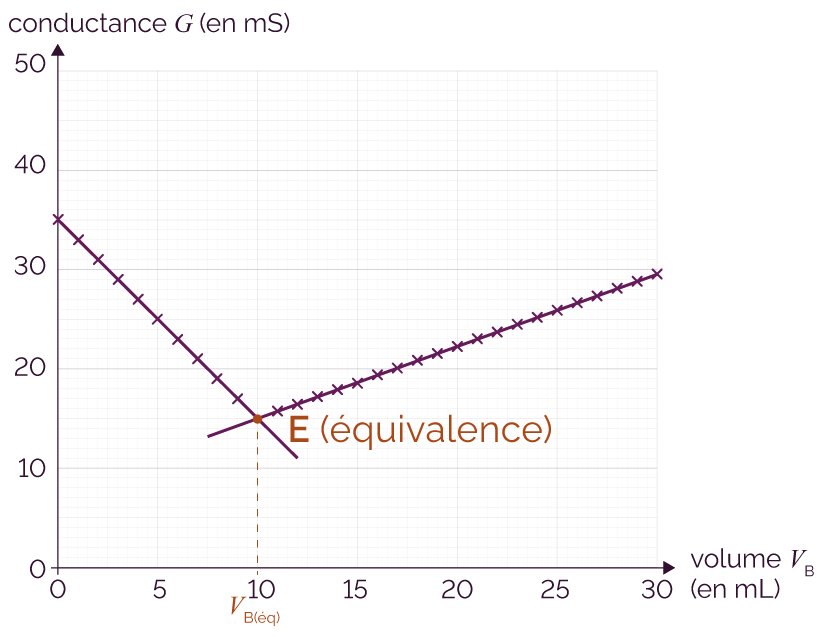
Représentation de la conductance
en fonction du volume de soude versé
On donne les valeurs des conductivités ioniques molaires pour certains ions en solution.
| Ion | H3O+ | HO– | Cl– | Na+ |
| λi (en mS·m2·mol–1) | 35,0 | 19,9 | 7,6 | 5,0 |
La conductance G est proportionnelle
à :
σ = λHO– × [HO–] + λH3O+ × [H3O+] + λCl– × [Cl–] + λNa+ × [Na+].
On remarque que les conductivités molaires
ioniques des ions Cl–
et Na+ sont
négligeables devant celles des
ions H3O+
et HO–. On ne va
donc pas tenir compte de ces ions dans
l’évolution de la conductance.
La conduction G évoluera donc
proportionnellement à :
λHO– × [HO–] + λH3O+ × [H3O+].
Avant l’équivalence, l’ajout des ions hydroxyde HO– neutralise progressivement les ions oxonium H3O+ présents en solution selon la réaction H3O+ (aq) + HO– (aq) → 2 H2O (l), ce qui entraine une baisse de la conductance G.
À l’équivalence, la conductance G n’est due qu’aux ions Cl– et Na+ car tous les ions hydroxyde HO– et oxonium H3O+ ont été consommés. La conductance est alors minimale.
Après l’équivalence, les ions hydroxyde HO– rajoutés s’accumulent dans le milieu réactionnel, ce qui entraine une hausse de la conductivité mesurée.
Le volume de soude versé à l’équivalence vaut VB(éq) = 10 mL. À l’équivalence, les espèces H3O+ et HO– sont introduites en proportions stœchiométriques.
Comme les coefficients stœchiométriques de ces deux espèces chimiques sont égaux à 1 dans la réaction support du titrage, on a donc :
CA × VA = CB × VB(éq).
La concentration de la solution d’acide chlorhydrique vaut ainsi :
CA =
![]()
CA =
![]()
CA = 2,5 × 10–4 mol·L–1

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








