Production d'eau potable, traitement des eaux
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
De plus, les réserves d’eau douces sont très inégalement réparties sur la planète. Les zones froides, tempérées et équatoriales sont dans l’ensemble assez bien pourvues. Par contre, le déficit en eau douce est manifeste dans les régions équatoriales, dont bien sûr les zones désertiques. Plus de deux milliards d’Hommes dans le monde sont concernés par des difficultés d’accès à l’eau potable (moins de 5 L par personne et par jour).
Les étapes sont :
• Le tamisage, afin de retirer une part des matières solides mélangées à l’eau.
• La décantation, où les matières solides résiduelles se déposent au fond du bassin par coagulation, puis par floculation (agrégations des impuretés).
• La filtration, où une couche de sable va retenir les matériaux les plus gros. Du charbon actif peut quant à lui fixer des micropolluants.
• L’ozonation. L’ozone mélangé à l’eau permet de tuer les bactéries et virus, et de désactiver certains toxiques (pesticides, …). Son action est également de supprimer d’éventuelles couleurs et odeurs de l’eau traitée, et d’améliorer son goût.
• La chloration évite que les bactéries puissent se développer, par désinfection de l’eau.
• La filtration. Par des grilles, les résidus solides sont récupérés et éliminés.
• La décantation : l’eau est envoyée dans des bassins, où les matières vont progressivement se déposer au fond. L’eau devient alors de plus en plus transparente. Les boues sont récupérées, et éventuellement valorisées (engrais)
• Traitement secondaire. L’eau est versée dans un bassin d’aération. Elle contient encore des matières organiques, qui consommeraient l’oxygène dissous lors de leur décomposition. Rejetés dans la Nature, cette eau appauvrie en porterait préjudice à la vie aquatique. Ainsi, du dioxygène est injecté dans le bassin. En parallèle, des bactéries ont pour rôle de « digérer » ces matières organiques.
• Traitement bactéricide. Si l’eau traitée est déversée en milieu « sensible » (zone de baignade, …), une désinfection de l’eau par ozone et/ou UV peut être effectuée.
La distillation
Quand de l’eau salée est porté à ébullition, la vapeur d’eau générée est exempte en sel. Ce constat est à la base de la désalinisation par distillation. A pression atmosphérique, l’eau doit être portée à 100 °C pour entrer en ébullition. Par contre, si la pression est abaissée, la température d’ébullition diminue aussi, ce qui limite l’énergie à apporter par chauffage.
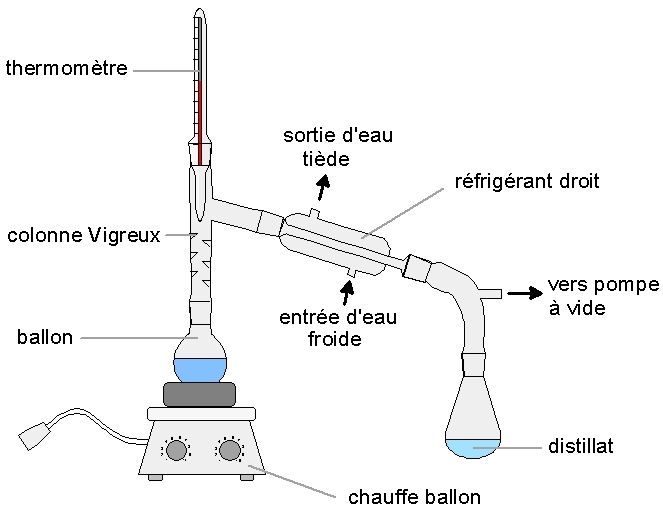
Dans le cadre de la désalinisation industrielle par distillation, deux technologies existent :
→ Distillation flash : vaporisation d’une partie de l’eau, par brusque détente du liquide.
→ Distillation à multiples effets : plusieurs évaporateurs en série.
Avantage :
• méthode relativement simple technologiquement.
Inconvénients :
• rejets de saumures (eau très salée) dans la Nature. L’eau rejetée est également chaude, ce qui peut aggraver l’effet environnemental.
• pollution chimique (chlore et cuivre).
• gourmande en énergie (
L’osmose et l’osmose inverse
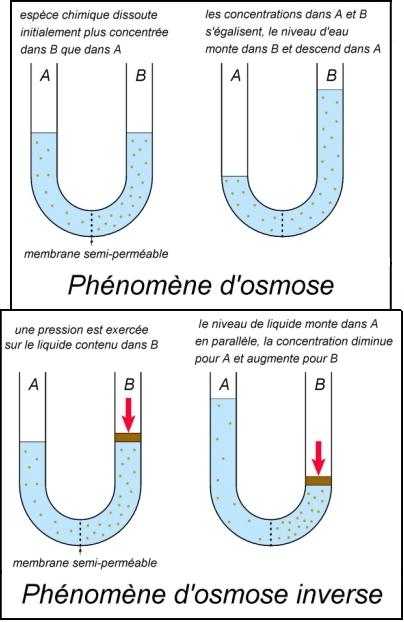
Dans un tube en U, on réalise les deux expériences décrites par le schéma ci-dessous. La membrane semi-perméable laisse passer les molécules constituant le liquide (l’eau), mais pas l’espèce chimique dissoute.
Dans le phénomène d’osmose, l’eau va migrer préférentiellement du compartiment le moins concentré (A), vers le plus concentré (B). Cela donne naissance à une force de pression au sein du liquide (pression osmotique), qui va faire que le liquide va monter dans la partie B.
Dans le phénomène d’osmose inverse, une pression est exercée sur le compartiment B, plus forte que la pression osmotique. Les molécules d’eau passent à travers la membrane, pour aller en A. Comme l’espèce chimique dissoute ne peut pas franchir la membrane, la concentration de B augmente de plus en plus. En A, par contre, la concentration diminue.
L’osmose inverse permet de produire de l’eau douce à partir d’eau salée. La pression osmotique de l’eau de mer est de l’ordre de 27 bars. La pression appliquée est de 50 à 80 bars pour les installations industrielles.
Avantages :
• technique non polluante, mis à part les rejets de saumure. Cependant, cette eau est à température ambiante.
• méthode moins couteuse énergétiquement (
• réalisation des dispositifs portables pour utilisation dans des régions difficiles d’accès.
Inconvénient :
• dépend de la solidité et de l’efficacité de la membrane utilisée (taille des pores). Les membranes coutent cher et s’usent avec le temps.
A noter que d’autres méthodes existent, comme l’électrodialyse. Mais, quelle que soit la méthode employée, l’eau pure n’est pas consommable en l’état. En effet, si l’eau de mer n’est pas potable, l’eau pure est aussi dangereuse en consommation régulière. Elle entraine progressivement avec elle les minéraux de l’organisme. Il est ainsi nécessaire de reminéraliser une eau désalinisée afin de la rendre potable.
|
|
supérieur à 7 | entre 5 et 7 | de 3 à 5 | inférieur à 3 |
| numérotation | 1A | 1B | 2 | 3 |
| qualité | eau d’excellente qualité | eau potable | eau industrielle | eau médiocre |
La quantité de dioxygène dissous se mesure par la méthode de Winkler. Tout d’abord, du chlorure de manganèse est mélangé à de l’hydroxyde de sodium, et versé dans l’eau étudiée. Il se produit la réaction
Ensuite, le milieu est acidifié, ce qui provoque la dissolution des hydroxydes de manganèse :
Après, des ions
Le principe du test d’ajouter du
Les
Une variante de la technique décrite ici consiste à remplacer les ions oxalates par
• La méthode de Mohr. Des ions chromates
• La méthode de Volhard-Charpentier. Un excès d’ions argent est versé dans la solution à titrer, consommant tous les ions chlorures :
L’eau salée peut être désalinisée par exemple par distillation ou par osmose inverse, afin de produire de l’eau douce qui pourra être rendue potable.
Une eau est potable si elle satisfait certaines contraintes : taux en dioxygène dissous, présence de matières organiques oxydables, etc. Il existe des manipulations visant alors à estimer la qualité d’une eau, selon ces divers paramètres.

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








