Chiralité / carbone asymétrique
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
L’effet magnéto-optique est une modification de la propagation d'une onde électromagnétique dans un matériau.
Expérience de Biot :
Un faisceau de lumière polarisée traverse un tube contenant une substance « optiquement active ». Le plan de polarisation du faisceau de lumière polarisée tourne d’un angle α.
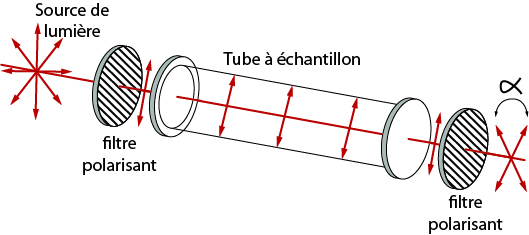
Cet appareil s’appelle un polarimètre.
L’angle α est défini par la loi de Biot :
[ α ] : pouvoir rotatoire spécifique mesuré en degrés (dépend de la substance)
L : longueur du tube en décimètre (dm).
c : concentration de substance active en gramme par millilitre (g/mL)
Une substance qui fait tourner le plan de polarisation de la lumière est dite « douée d'un pouvoir rotatoire », ou encore « optiquement active ».
En triant des cristaux d’acide tartrique d’aspect différent, il met en évidence deux structures différentes : une fois dissoutes dans de l’eau, une des formes fait tourner le plan de polarisation de la lumière dans un sens, et l’autre, dans l’autre sens.
Ces deux formes sont des isomères optiques, appelés énantiomères, qui possèdent les mêmes propriétés chimiques (réactivité). La plupart de leurs propriétés physiques (point d'ébullition, de fusion, indice de réfraction, conductivité électrique etc.) sont identiques. Certaines propriétés physiques (polarisation rotatoire de la lumière, piézo-électricité) sont différentes.
Deux énantiomères ont des pouvoirs rotatoires spécifiques [ α ] égaux en valeur absolue mais de signes opposés.
La chiralité est une propriété géométrique d’un objet non superposable à son image dans un miroir.
Le mot « chiral » vient du mot « cheir » qui signifie « main » en grec, car la main droite n’est pas superposable à la main gauche : la main est un objet chiral.
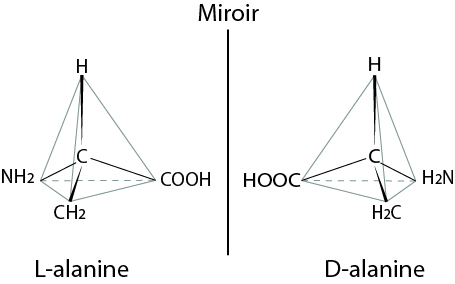
Une molécule est dite chirale si elle possède deux énantiomères qui sont images l’un de l’autre dans un miroir et qui ne sont pas superposables.
En chimie organique : les acides α-aminés sont des molécules chirales ; la L-alanine et la D-alanine sont deux molécules images l’une de l’autre dans un miroir.
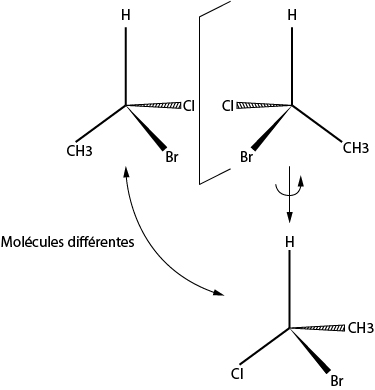
La molécule de bromochloroéthane admet deux énantiomères : en effectuant une rotation de 120°, on vérifie que les deux molécules ne sont pas superposables.
En chimie de coordination, cet ion complexe du fer admet deux énantiomères : les ligands sont fixés différemment sur l’atome central.
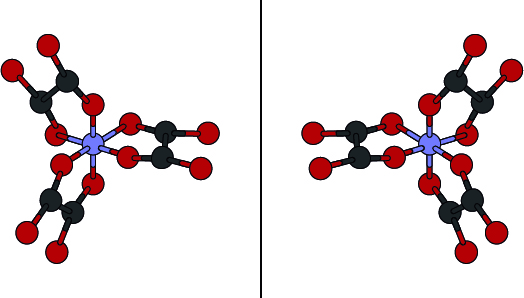
Cela peut former deux formes non-superposables dans un miroir, des énantiomères dénommés R et S (de Rectus et Sinister, droit et gauche en latin).
Un tel atome de carbone est habituellement appelé « carbone asymétrique ». La présence d'un tel atome de carbone dans une molécule la rend chirale.
La molécule de 2-chlorobutane présente un carbone asymétrique. Elle est chirale.
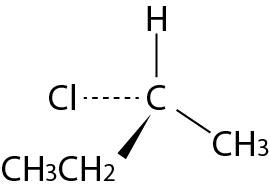
Dans une molécule, on note les atomes de carbone asymétrique avec un astérisque C*.
Dans la molécule de phénylalanine, le carbone asymétrique porte quatre substituants différents.
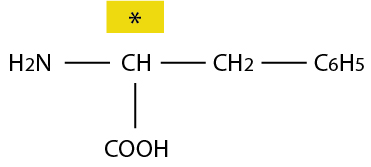
• Une molécule optiquement active est dite chirale ; elle admet deux énantiomères qui sont images l’un de l’autre dans un miroir et qui ne sont pas superposables.
• Une molécule organique chirale contient un carbone asymétrique, qui porte quatre substituants différents.

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








