Mers, océans, climat ; traceurs chimiques et isotopiques
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
La densité de l’eau de mer est ainsi supérieure à celle de l’eau pure (1 par définition), car elle est salée. Elle constitue une solution ionique, de pH moyen 8,1 (basique), constituée principalement par le chlorure de sodium
Sur 1 kilogramme d’eau de mer de salinité 35g/kg (salinité moyenne des océans) :
• 965 g d’eau
• 19,4 g d’ions chlorure
• 10,8 g d’ions sodium
• 2,71 g d’ions sulfate
• 1,28 g d’ions magnésium
Le reste concerne les ions calcium, potassium, hydrogénocarbonate
Remarque :
La salinité des océans est stable, même si les fleuves rejettent continuellement du sel dissous (voir fiche érosion, dissolution, concrétion). Des mécanismes sont proposés pour expliquer cela, dont des réactions entre l’eau de mer et le basalte (roche volcanique) qui compose la croûte océanique.
Les courants marins sont activement étudiés, de part le rôle qu’ils jouent, ou sont supposé jouer, sur les climats de certaines régions du globe :
• Le Gulf Stream est un courant marin chaud qui prend naissance en Floride, et qui va jusqu’aux côtes de l’extrême nord de la Norvège. Il est supposé intervenir dans le climat de l’Europe de l’Ouest, dans une proportion encore mal connue.
• El Niño est au courant marin chaud au large du Pérou. Ce courant est souvent associé à des phénomènes d’anomalies climatiques dans l’Océan Pacifique Sud.
• Température de surface
• Vents de surface
• Aspect des glaces (pour les calottes polaires)
• Couleur (liée à la vie marine de surface, via la chlorophylle)
• Niveau de la mer (il varie selon le lieu et selon la profondeur)
Ces mesures sont couplées avec des mesures effectuées en surface (salinité, concentration en
→ Les traceurs isotopiques sont constitués par des isotopes différents de l’isotope le plus abondant dans la Nature. On en distingue deux catégories :
• Les isotopes stables, comme le carbone 13 et l’oxygène 18 (étudié partie 4.). Ils ne sont pas radioactifs et ne se désintègrent donc pas.
• Les isotopes radioactifs, caractérisés par un temps de demi-vie
Les isotopes radioactifs sont soit naturels (carbone 14), soit artificiels (soit les deux). Exemples : tritium, protactinium 231, thorium 230, néodyme, strontium. Certains ont été émis lors des essais nucléaires aériens, durant la Guerre Froide. Comme leur présence dans la Nature est « récente » (quelques décennies), on peut suivre leur propagation dans les océans : ils n’ont pas encore atteint certaines profondeurs. En effet, la circulation océanique des grands fonds se déroule sur des échelles en temps de plusieurs centaines d’années. De manière imagée, c’est comme suivre l’évolution d’un colorant versé dans un fleuve.
→ Les traceurs chimiques. Au cours du XXème siècle, des chlorofluorocarbures (ou chlorofluorocarbones CFC) ont été synthétisés par l’Homme. Ces gaz sont des dérivés d’alcanes où les atomes d’hydrogène ont été remplacés par des halogènes : fluor et chlore. Ils ont été utilisés notamment comme gaz réfrigérants (réfrigérateurs), gaz propulseur (bombes aérosols). Cependant, ils furent progressivement interdits dès 1987 (protocole de Montréal) à cause de leurs effets sur la couche d’ozone.
Les CFC émis il y a plusieurs années sont encore présents dans l’atmosphère, et se propagent encore dans les profondeurs océaniques. Comme pour certains isotopes radioactifs, leur introduction dans la Nature est récente : il n’en existait pas avant leur synthèse par l’Homme (on parle de traceurs transitoires). Ainsi, les CFC sont des traceurs chimiques très étudiés dans les océans. Il a été constaté que leur solubilité dépend de la salinité des eaux. De plus, ils sont inertes chimiquement dans le milieu marin.
Remarque : les traceurs artificiels décrits ici ont été introduits « accidentellement » dans le milieu marin !
Il est courant de définir l’écart relatif par rapport à la proportion standard de l’eau de mer par la notation
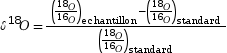 , où
, où Après,
En outre, le phénomène est accentué par des basses températures. Quand il fait froid,
Dans les régions froides (zones polaires), les précipitations neigeuses s’accumulent en formant des couches de glace. Par des carottages en Antarctique, des glaces très anciennes sont analysées. Un forage de 1500 mètres fournit des glaces âgées de 100 000 ans. Cela autorise l’étude des climats anciens (paléoclimats) :
• Lors d’une période glacière, de grandes quantités d’eau (précipitations neigeuses) s’accumulent dans les glaciers et calottes glacières. Comme vu plus haut, le taux en
• Lors d’une période chaude, les glaciers et calottes glacières sont plus réduits. Le niveau des océans est plus élevé. Ce phénomène de montée des eaux est accentué par la dilatation de l’eau liquide. Tout cela entraine une dilution des taux en
Les mers et océans ont une importance certaine sur le climat. L’analyse de traceurs océaniques, comme les gaz atmosphériques dissous, fournissent de précieuses informations, par exemple sur les mouvements des masses d’eau. Les traceurs isotopiques radioactifs émis par les essais nucléaires de la Guerre Froide, ainsi que les chlorofluorocarbones (CFC) utilisés au siècle dernier (traceurs chimiques) sont notamment mesurés.
D’autre part, l’oxygène 18 est un isotope naturel stable, constituant un traceur isotopique important, car sa concentration dans les carottes de glace est un témoin des climats anciens (paléoclimats).

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








