Spectres Ultraviolet -Visible
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
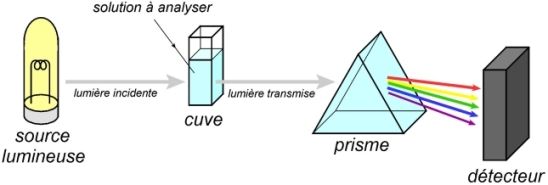
Habituellement, pour les spectres UV-Visibles, les longueurs d’onde
• Dans l’UV : de 190 à 400 nm. On parle de proche UV.
• Dans le visible : de 400 nm à 750 nm.
La source lumineuse doit pouvoir émettre une lumière polychromatique continue dans ces domaines de longueurs d’onde. Les lampes à décharge au xénon en sont capables. Sinon, il est aussi possible d’utiliser deux sources en même temps : l’une assurant la partie visible (filament au Tungstène par exemple), et l’autre la partie UV (lampe à décharge au deutérium).
La solution placée dans la cuve contient la molécule à étudier. Il existe aussi la possibilité de travailler en phase gazeuse, avec des cuves étanches. Pour travailler dans l’UV, la cuve ne peut pas être en verre ou en plastique, car ces matériaux absorbent les UV. On utilise alors des cuves en quartz.
Le rôle du prisme est de séparer les diverses radiations (diverses longueurs d’onde) qui ont été transmises à travers la cuve. Certains spectrophotomètres peuvent utiliser un réseau optique à la place, c'est-à-dire un ensemble de raies très fines, qui agissent comme le prisme.
Le détecteur va mesurer l’intensité lumineuse I transmise pour chacune des longueurs d’onde. Les barrettes de diodes sont bien adaptées à cet usage. Elles consistent en un alignement de photodiodes (capteurs lumineux) mesurant simultanément l’intensité pour plusieurs
Pour une longueur d’onde donnée, l’intensité transmise I satisfait la double inéquation
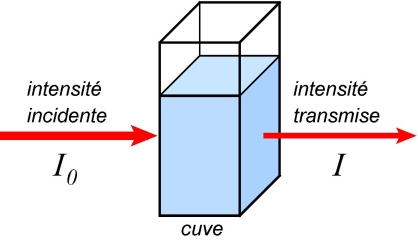
On appelle transmittance le rapport
Pour chaque longueur d’onde
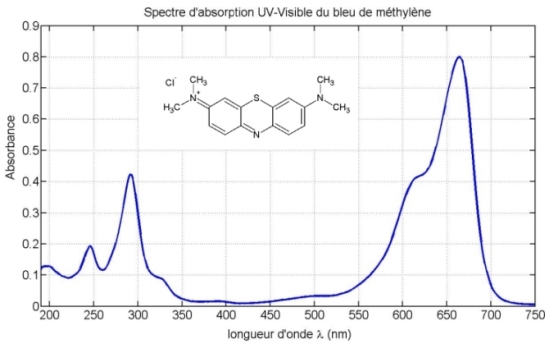
Une molécule est dite colorée parce qu’elle absorbe certaines radiations lumineuses dans le domaine du visible, et pas d’autres. Cela se manifeste par un maximum d’absorption sur le spectre.
Considérons la « roue des couleurs » :
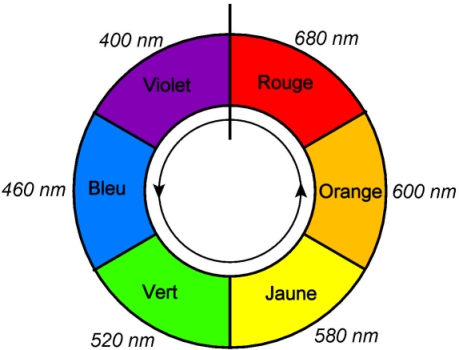
Quand une molécule présente un maximum d’absorbance pour une longueur d’onde
Pour le bleu de méthylène,
Une conséquence directe de cet effet est que le chromophore peut absorber des photons (particules lumineuses) de certaines longueurs d’onde. Si la molécule ne possède qu’une structure de type chromophore (et rien d’autre), il existe un lien direct entre la longueur n du chromophore (nombre de doubles liaisons) et la longueur d’onde
| Valeur de n |
|
| < 8 | < 400 nm (UV) |
| 8 | 400 nm (Violet) |
| 9 | 430 nm (Indigo) |
| 10 | 460 nm (Bleu) |
| 11 | 490 nm (Cyan) |
Par exemple, le beta-carotène possède un chromophore de longueur
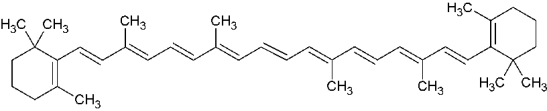
Remarque : Les doubles liaisons d’un chromophore peuvent être formées à partir de doubles liaisons carbone-carbone C=C, mais aussi par des groupements azoïques
• Augmentation de
• Diminution de
• Augmentation de l’absorbance (notamment pour
• Diminution de l’absorbance : effet hypochrome.
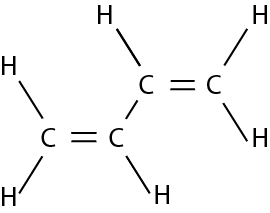
Molécule de diène
Après, chaque fois que l’on rajoute un groupement au chromophore, on ajoute un incrément au
La valeur de l’incrément est donnée par la liste (non exhaustive) ci-après :
• Ajout d’une double liaison conjuguée : + 30 nm
• Groupement alkyle (ex
• Ether
• Thioéther
• Amine
•
Donc, par exemple, si on allonge la longueur du chromophore,
Dans cette formule : l est la largeur de la cuve, c'est-à-dire la distance parcourue dans la solution par la lumière. Elle est exprimée habituellement en cm. Ensuite,
En conclusion, l’absorbance A est proportionnelle à la concentration c ; en pratique, on mesure l'absorbance et on en déduit par calcul la valeur de la concentration.
Un spectre UV-Visible d'une molécule colorée présente un maximum d’absorption pour une longueur d’onde
Une molécule colorée a la faculté d’absorber sélectivement des longueurs d’onde, en fonction de son chromophore et des éventuels effets d’auxochromes, qui peuvent agir sur la valeur de
Les spectres UV-Visible sont utilisés dans le cadre du dosage de molécules colorées, via la loi de Beer Lambert

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








