Spectres infrarouge
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
Pour les liaisons chimiques, ces fréquences se situent dans l’infrarouge. En conséquence, le principe d’une spectroscopie IR est d’envoyer des radiations IR sur un échantillon à tester. Certaines longueurs d’onde sont alors absorbées par les liaisons chimiques des molécules se trouvant dans l’échantillon. On génère alors un spectre IR, qui permet de déterminer ces liaisons chimiques.
Une spectroscopie infrarouge peut ainsi avoir différentes finalités:
• Identifier et caractériser une molécule inconnue, en référençant ses liaisons.
• Tester la présence ou l’absence d’une molécule dans un échantillon.
• Dans certains cas, procéder à un dosage d’une espèce chimique.
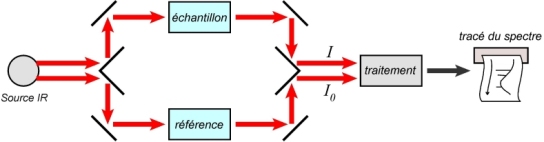
Le faisceau du haut passe à travers l’échantillon testé. Le faisceau du bas correspond à un témoin. Comme pour l’UV, les réceptacles recevant les échantillons ne peuvent pas être en verre, car celui-ci est opaque pour les radiations IR utilisées. Dans la pratique, on emploie par exemple des pastilles de chlorure de sodium monocristal, ou du bromure de potassium. Pour chaque longueur d’onde, l’intensité
Pour établir le spectre, au lieu de la longueur d’onde, il est courant de manipuler le nombre d’onde, noté
NB : Le nombre d’onde d’une radiation est proportionnel à sa fréquence f :
Dans la pratique, le domaine IR étudié s’étend sur un domaine en longueur d’onde de
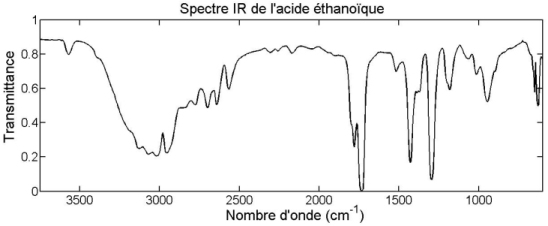
Les fortes baisses localisées de la transmittance, pour certains nombres d’onde, correspondent à l’absorption sélective des liaisons chimiques. Ces baisses sont nommées bandes d’absorption.
• Pour les liaisons faisant intervenir un atome d’hydrogène (léger), le nombre d’onde d’absorption est élevé : zone entre 2500 et
• Le reste du domaine spectral d’étude concerne alors les liaisons où l’hydrogène n’intervient pas, comme
Pour les hydrocarbures :
| Structure | Nombre d'onde d'absorption des liaisons | |
| Alcane |
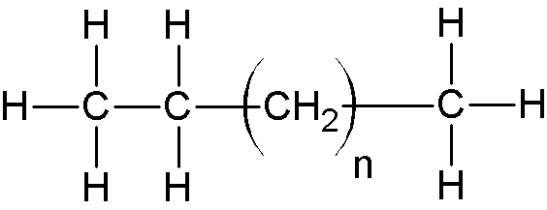 uniquement des liaisons C-C |
(souvent invisible) |
| Alcène |
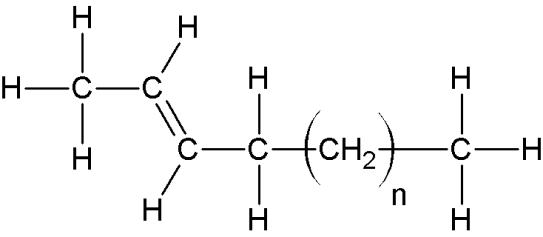 une ou plusieurs liaisons C=C |
(H relié au C double liaison) |
| Alcyne |
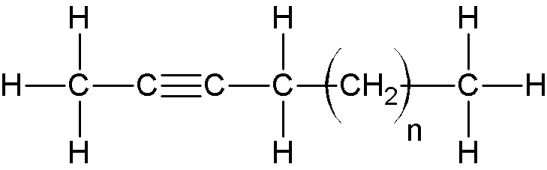 une ou plusieurs triples liaisons |
(H relié au C triple liaison) |
Une liaison chimique est également influencée par son environnement au sein de la molécule. On le remarque avec
On appelle groupe caractéristique (ou groupe fonctionnel) un groupement d’atomes qui donne une propriété particulière à une molécule. On parle de fonction (organique) pour désigner cette propriété. La fonction permet de classer les molécules en familles : les alcools, les amines, etc.
Lors d’une spectroscopie IR, une liaison chimique impliquée dans un groupement caractéristique présente un nombre d’onde d’absorption déterminé. En conséquence, un spectre IR d’une molécule permet de déterminer ses liaisons chimiques, mais aussi d’identifier les groupes caractéristiques. Le tableau ci-dessous propose de référencer quelques groupes caractéristiques, en précisant le nombre d’onde d’absorption pour les liaisons concernées.
| Groupe caractéristique | Fonction associée | Formule | Nombre d’onde d’absorption des liaisons |
| Hydroxyle | Alcool |
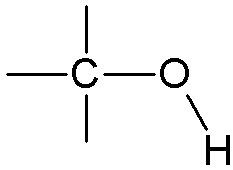
|
|
| Hydroxyle | Phénol |
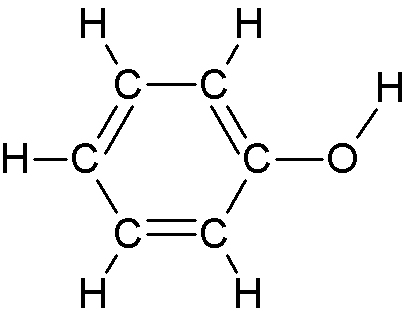
|
|
| Carbonyle | Aldéhyde |
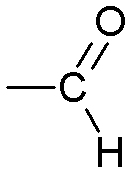 (en fin de chaîne carbonée) |
|
| Carbonyle | Cétone |
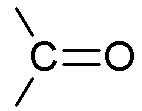
|
|
| Carboxyle | Acide carboxylique |
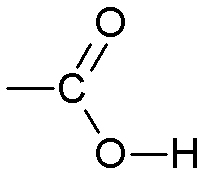
|
|
| Ester | Ester |
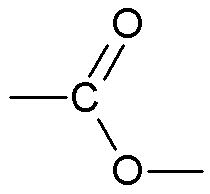
|
|
| Amine |
Amine (primaire) |
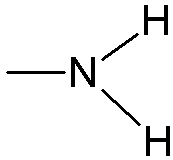
|
|
| Amide | Amide |
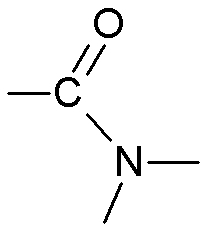
|
|
Remarques :
→ Dans la littérature, il est souvent précisé la forme (fine ou large) et l’intensité (F : forte, M : moyenne) des bandes d’absorption.
→ Notamment avec les alcools et les acides carboxyliques, il y a possibilité de formation de liaisons hydrogènes, par exemple entre le H d’un groupement hydroxyle/carboxyle et un O d’une autre molécule.
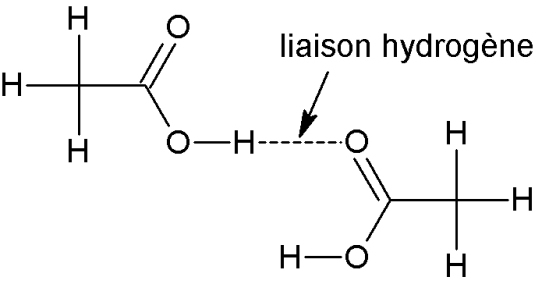
La liaison hydrogène interfère sur la liaison
→ Les valeurs données sont indicatives. Elles peuvent en effet varier dans la littérature, car elles sont très liées au protocole de mesure du spectre. Notamment, le solvant employé est susceptible de créer (ou pas) des liaisons hydrogènes avec la molécule étudiée (solvant polaire ou apolaire). On peut d’ailleurs préférer une spectroscopie en phase gazeuse si on souhaite s’affranchir des ces effets (notamment l’élargissement de la bande de
→ Pour des molécules comportant assez d’atomes, des liaisons ont plusieurs manières de vibrer. On recense deux modes de vibration principaux : stretching (allongement) et bending (déformation). Ce dernier mode comporte lui-même divers types de vibrations. Cela entraîne la présence de plusieurs nombres d’onde d’absorption pour une même liaison. Les valeurs données dans les tableaux ne concernent que le mode stretching.
→ Dans les cycles benzéniques (donc pour le phénol), la délocalisation des électrons des doubles liaisons
→ Pour une amine de structure
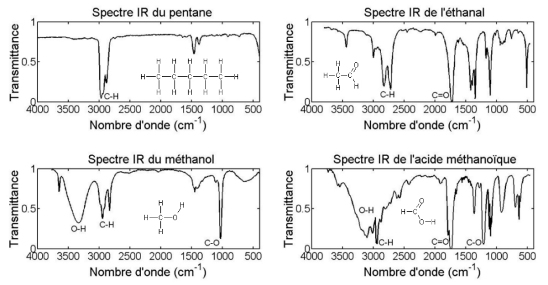
Pour rappel, le pentane est un hydrocarbure, l’éthanal un aldéhyde, le méthanol un alcool et l’acide méthanoïque un acide carboxylique.
Un spectre IR d’un échantillon indique la transmittance fonction du nombre d’onde. Le nombre d’onde

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








