Catalyse homogène, hétérogène et enzymatique
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
• Quels sont les types de catalyses ?
• Comment le catalyseur intervient-il dans la transformation ?
• Le catalyseur peut être un solide, un liquide ou plus rarement un gaz.
• Le catalyseur ne figure pas dans l’équation de la réaction ; il n’influence pas le sens d’évolution de la transformation, ni la composition du système dans l’état final.
• Le catalyseur est spécifique à une réaction donnée.
Par exemple, le cuivre est catalyseur des réactions de déshydrogénation (élimination d’une molécule de dihydrogène) des aldéhydes et des cétones, mais ne catalyse pas les réactions de déshydrogénation des alcanes.
• Une même réaction chimique peut être catalysée par différents types catalyseurs.
L’eau oxygénée se décompose lentement. Au cours de cette transformation, il se forme de l’eau et du dioxygène gazeux selon l’équation :
On remarque que la quantité d’eau oxygénée décroît plus rapidement en présence d’un catalyseur que sans catalyseur. La vitesse de la réaction augmente en présence d’un catalyseur.
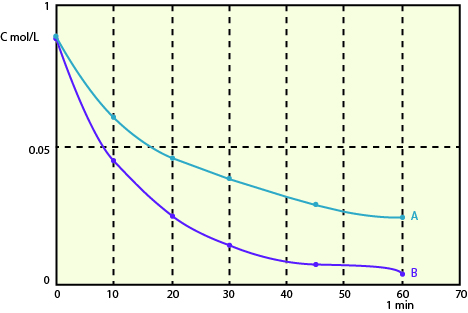
• La vitesse de la réaction augmente lorsque la concentration (molaire ou massique) en catalyseur augmente.
• Le catalyseur intervient au cours de la transformation chimique, mais il est régénéré tout au long de la réaction : on le trouve quasiment intact en fin de réaction.
Exemple :
La réaction de décomposition de l'eau oxygénée peut être catalysée par les ions fer (III) en solution aqueuse.
On la représente par :
Au cours de cette transformation, la couleur orange des ions fer (III) en solution disparaît puis réapparaît : les ions fer (III) ont participé à la transformation mais ont été régénérés en fin de réaction.
La vitesse de la réaction augmente lorsque l’état de division du catalyseur augmente.
• En effet, plus la surface de contact entre le catalyseur et les réactifs est élevée, et plus la réaction est rapide. On utilise généralement un catalyseur en poudre ou en mousse plutôt qu’en fil ou en lame.
Exemple :
La réaction de décomposition de l'eau oxygénée peut être catalysée par le platine solide en solution aqueuse.
On la représente par :
Le platine n’est pas consommé. Le fil de platine n’est pas altéré par la réaction
• Une enzyme est une protéine élaborée par un être vivant qui contient un site actif.
Exemple :
La réaction de décomposition de l'eau oxygénée peut être catalysée par la catalase, enzyme présente dans le sang ou dans le navet. On la représente par :
Exemple :
La réaction d’oxydoréduction entre les ions permanganate et l’acide oxalique est catalysée par les ions manganèse formés au cours de la réaction.
On la représente par :
• Mais la catalyse est aussi utilisée dans de très nombreux autres domaines tels que :
- le raffinage pétrolier
- le traitement des eaux
- la production de dihydrogène
- la production de biocarburants
- le recyclage chimique des matières plastiques
- les réactions de polymérisation
• Les intérêts de l’utilisation des catalyseurs dans l’industrie chimique sont nombreux :
- utilisation plus faible de réactifs et création de moins de déchets : c’est moins coûteux en matières premières et plus écologique.
- les réactions sont plus rapides et permettent de faire des économies d’énergie.
Chaque réaction est catalysée par une unique enzyme, qui est constituée d’un site actif propre au substrat. Le substrat est transformé en produits.
Voici un schéma présentant le mode d’action d’une enzyme :
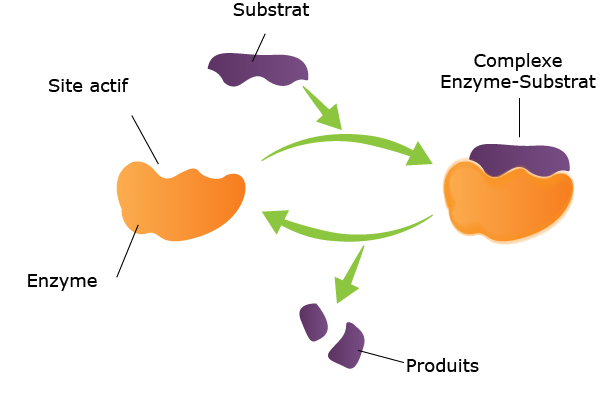
Exemples :
• L’amylase alpha hydrolyse l’amidon en sucres.
• L’hydrolyse du saccharose est fonction de la température, du pH et de la concentration, mais les deux enzymes entrant en jeu sont l'alpha-glucosidase et la béta-fructosidase.
• Il existe plusieurs types d’enzymes selon le type de réaction qu’elles catalysent (par exemple, les oxydo-réductases catalysent les réactions d’oxydo-réduction).
• Outre leur importance dans les processus biologiques, les enzymes présentent un intérêt industriel.
On utilise en effet des enzymes dans les biotechnologies : production de lessives, production de sirop de fructose à partir d’amidon de maïs par exemple, production de la bière par fermentation de l’orge en acides aminés et sucres…
• Il existe plusieurs types de catalyse : la catalyse homogène ( = réactifs et catalyseur forment une seule phase), la catalyse hétérogène ( = réactifs et catalyseur forment plusieurs phases) et la catalyse enzymatique.
• La catalyse a une grande importance dans le domaine biologique et dans le domaine industriel.

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








