Constante d'Avogadro, évaluer des ordres de grandeurs
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
Quand on manipule des grands nombres, on les groupe en « paquets » : millions, milliards, … et/ou on emploie des exposants. La solution retenue en chimie est de considérer la mole, c'est-à-dire une collection d’« objets » identiques (molécules, atomes, …). Le nombre d’entités dans une mole est donnée par le nombre (ou constante) d’Avogadro
La mole a été définie comme le nombre d’atomes de carbone contenus dans 12 grammes de carbone 12 pur. De part cette définition,
l’unité
De part le nombre colossal que représente
L’Univers a environ
Cela a donné la loi d’Avogadro, aussi connue sous le nom de loi des gaz parfaits :
La pression P est en Pa, le volume V en
Cette constante résulte de la relation :
La loi des gaz parfaits est une parfaite illustration du lien entre microscopique et macroscopique, car cette loi rend compte du comportement des molécules d’un gaz. En effet, les molécules, par leur agitation désordonnée, donnent lieu à la température. D’autre part, par leurs chocs répétés contre les obstacles (parois), cela donne alors la pression.
Remarque : la loi des gaz parfaits peut être vue comme une généralisation de la formule
Le e est la charge élémentaire, c'est-à-dire la charge du proton, ou celle de l’électron en valeur absolue.
La constante de Faraday est utilisée par exemple en électrochimie, pour étudier le fonctionnement d’une pile, d’un accumulateur électrique, d’un électrolyseur (cours 1ère S). En effet, il permet de faire le lien entre les formules électriques et les relations de chimie.
Plus précisément,
On peut alors estimer la quantité (puis la masse) de cuivre formé ou de zinc consommé au niveau des électrodes de la pile.
L’unité de masse atomique est utile pour estimer la masse d’atomes/molécules, mais est aussi utilisée en physique nucléaire. En effet, la masse d’un électron est presque 2000 fois plus faible que celle d’un nucléon (proton ou neutron). La masse d’un noyau est ainsi considérée égale à celle de l’atome correspondant, et peut s'exprimer en u.
En physique nucléaire, il est courant de « convertir » une masse m en énergie
Des équipes de scientifiques ont pour objectif d’améliorer la précision de telle ou telle constante. Les progrès technologiques, mais aussi l’ingéniosité des expérimentateurs, permettent ces avancées. Une fois les résultats validés par la communauté scientifique, ils sont publiés. Le site ci-après rend accessible les dernières mises à jour :
http://physics.nist.gov/cuu/Constants/.
Il en est de même pour le nombre d’Avogadro dont la valeur approchée a été vue au 1. D’ailleurs, ce fut le scientifique Français Jean Perrin (1870-1942) qui nomma cette constante en l’honneur d’Avogadro. De plus, il proposa en 1908 une estimation correcte de
→ Une technique (Bower et Davis en 1975) fut de trouver la valeur de la constante de Faraday, pour ensuite en déduire une valeur du nombre d’Avogadro, voir 2.b. Pour cela, il fut utilisé un montage d’électrolyse. D’un côté, il fut mesuré la charge électrique qui a transité dans le circuit. De l’autre, il fut mesuré la variation de la masse d’une anode en argent.
→ Un programme nommé the International Avogadro Coordination confectionna des boules de silicium monocristal, les plus pures possible. Les opérateurs ont fait en sorte que la masse d’une boule soit de un kilogramme, avec une imprécision de seulement quelques microgrammes. Ensuite, des mesures furent effectuées sur la boule, pour trouver notamment sa masse volumique. Par diffractométrie de rayons X, il fut déterminé le paramètre de maille a du cristal de silicium (arrête du cube), voir schéma ci-dessous (structure de type diamant).
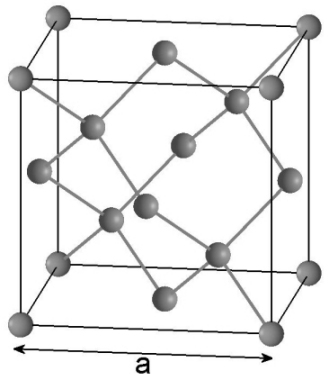
Cette constante a été nommée de la sorte par Jean Perrin, en hommage aux travaux d’Amedeo Avogadro. Perrin a d’ailleurs proposé des méthodes afin d’estimer

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








