Emission et absorption quantiques
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
Plus tard, la mécanique quantique, avec l’équation de Schrödinger, parvint à modéliser l’atome d’hydrogène, en tant que système {proton + électron}.
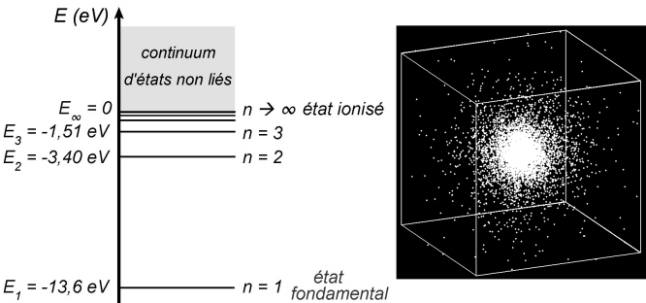
Conventionnellement, l’énergie nulle est celle de l’état où le proton et l’électron sont au repos et ne sont pas liés (hydrogène ionisé). Une énergie positive correspond à un état non lié, où ladite énergie est l’énergie cinétique de l’électron par rapport au proton. Ces états non liés forment un continuum, voir le diagramme d’énergie de l’atome d’hydrogène ci-dessous.
Une différence majeure avec la mécanique de Newton est que la mécanique quantique est une théorie probabiliste. Ci-dessous à droite, on a représenté par un nuage de points la densité de probabilité de l’électron dans l’atome d’hydrogène, pour l’état fondamental. En un lieu donné, plus il y a de points, plus on a de chance d’y trouver l’électron. Quelle différence avec le modèle planétaire de Rutherford ! Le proton, invisible, est au centre du nuage.
Pour rappel, l’électronvolt est une unité d’énergie adaptée à la physique de l’atome, définie comme
Absorption
Un électron est dans un état d’énergie, nommé ici
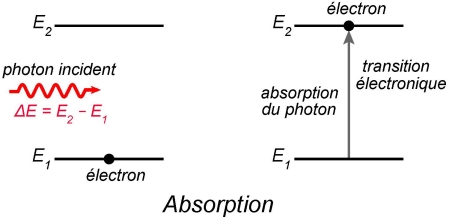
Si l’énergie du photon est suffisante, il peut ioniser l’atome, en amenant l’électron dans le continuum des états non liés. Une part de l’énergie du photon sert ainsi à ioniser l’atome, l’énergie restante est emportée par l’électron sous forme d’énergie cinétique.
Emission spontanée
Quand un électron est dans un état excité,
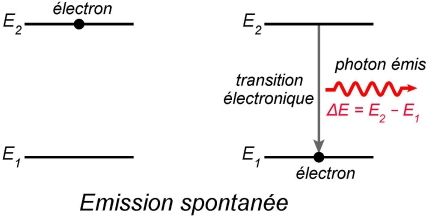
Remarque : Nous verrons dans la fiche sur le LASER qu’il existe un autre type d'émission, l’émission stimulée, induite par un photon incident.
Spectre d’émission :
Le montage expérimental permettant d'établir un spectre d’émission est schématisé ci-dessous. Une circulation forcée d’électrons dans le gaz étudié provoque des chocs avec les atomes. Les électrons de ces derniers passent alors sur des états excités.
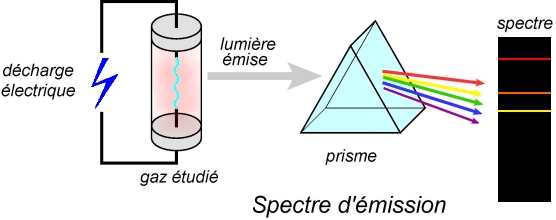
Rapidement (typiquement
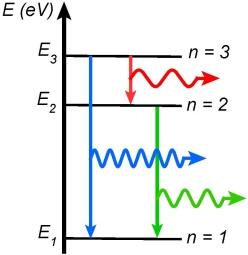
Chaque type d’atome possède des niveaux d’énergie qui lui sont propres. Le spectre d’un atome est ainsi sa carte d’identité, ce qui permet de l’identifier. D’autre part, la lumière produite par un spectre d’émission est également exploitable en tant que source lumineuse. Les lampes à vapeur de sodium sont employées par exemple pour l’éclairage urbain. Elles émettent une lumière jaune caractéristique.
Spectre d’absorption :
Pour obtenir un spectre d’absorption, une lumière blanche, comportant toutes les longueurs d’onde du visible, est envoyée sur les atomes à étudier (gaz).
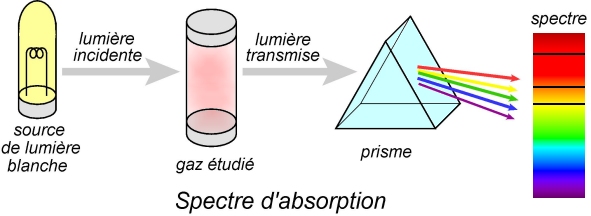
Certains photons (pouvant induire des transitions électroniques) sont absorbés par ces atomes. Rapidement, par émission spontanée, ils seront réémis, mais selon des directions aléatoires. Pour l’observateur, il y aura un manque d’intensité pour ces longueurs d’onde absorbées, ce qui se traduira par des raies noires sur le spectre obtenu.
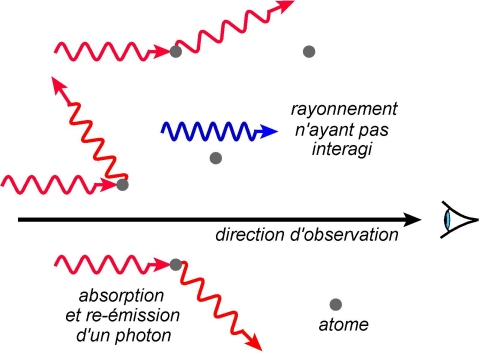
Remarque : pour un même type d’atomes, les raies sombres se situent bien entendu au même endroit que les raies brillantes du spectre d’émission.
A température donnée, les atomes (gaz) possèdent une vitesse, du fait de leur agitation thermique. Si un atome et un photon se propageant en sens opposés se rencontrent et s’il y a absorption du photon par l’atome, la vitesse de ce denier diminue, par conservation de la quantité de mouvement :
Après, quand l’atome émet un photon par émission spontanée, sa vitesse est également affectée, par effet de recul comme avec une arme à feu. Toutefois, comme l’émission du photon se fait dans une direction aléatoire, sa contribution est nulle en moyenne.
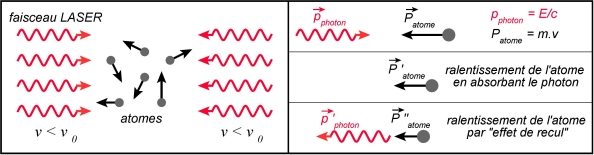
Deux faisceaux LASER sont émis dans des sens opposés sur une population d’atomes identiques. La fréquence des photons est égale à
Quand un atome va à la rencontre d’un photon, il peut « voir » celui-ci avec une fréquence
Comme les atomes ne se déplacent pas selon un axe mais en 3D, il faut 6 faisceaux LASER au total, soit deux par dimension. L’expérience du refroidissement d’atomes par LASER a valu le prix Nobel de Physique en 1997 à Claude Cohen-Tannoudji, Steven Chu et William Daniel Phillips. Dans cette expérience, par des améliorations du procédé, il fut descendu à des températures de l’ordre du nano-Kelvin au dessus du zéro absolu (0 K).
Dans un atome, les électrons peuvent passer d’un état d’énergie à un autre par des transitions quantiques. Dans le cadre de l’interaction lumière/matière, ces transitions sont l’absorption et l’émission. Elles mettent en jeu le photon d’énergie

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








