Capacité thermique - variation de température et d'énergie interne
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
Lorsque le système n’est pas soumis à un changement d’état et n’est pas le siège de réactions chimiques ou nucléaires, une variation de sa température
La constante de proportionnalité C est nommée capacité thermique. Elle s’exprime en J/K. La taille du système intervient dans la valeur de C : à
Pour un système homogène composé d’un seul matériau, on introduit alors une capacité thermique massique
La masse m du système est en kg, c est en
| Matériau |
Eau (liquide) |
Eau (glace) |
Bois | Béton | Pierre | Verre | Acier | Plomb |
|
c ( |
4185 | 2060 |
|
920 | 870 | 840 | 480 | 130 |
On peut aussi faire appel à une capacité thermique molaire
Si le système est composé de matériaux différents, on peut traiter chacun indépendamment des autres, car l’énergie est une grandeur additive.
Par exemple pour un système constitué de deux matériaux 1 et 2, on a :
Pour un système isolé thermiquement et n'échangeant pas de travail avec l’extérieur, on rappelle que
Remarque : Quand un système n’échange que de la chaleur avec son environnement,
La relation
Lorsqu’il y a changement d’état de la matière, il faut prendre en compte la chaleur latente de changement d’état correspondante, c'est-à-dire l’énergie échangée pour effectuer la transformation. Le nom des différents changements d’états est rappelé ci-après :
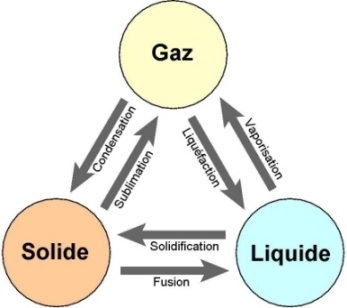
La variation d’énergie interne associée au changement d’état d’un corps de masse m est donnée par :
L est la chaleur latente massique de changement d’état, et s’exprime en J/kg. Elle ne dépend que du corps considéré. Deux cas de figure :
• Lorsqu’il y a fusion, vaporisation ou sublimation,
• Lorsqu’il y a solidification, liquéfaction, condensation,
Les chaleurs latentes de solidification, de liquéfaction et de condensation sont de valeurs opposées respectivement aux chaleurs latentes de fusion, vaporisation et sublimation :
| Matériau |
Eau (glace) |
Aluminium | Plomb |
|
|
334 | 330 | 25 |
| Matériau |
Eau (liquide) |
Ethanol | Méthane |
|
|
2260 | 840 | 760 |
On peut interpréter
Remarque : La glace d’eau ne fond exactement à 0°C et l’eau ne bout à 100 °C que pour une pression de 1 atm. A cette pression, la glace passe par la phase liquide, puis par la phase gazeuse. Au contraire, à basses pressions (
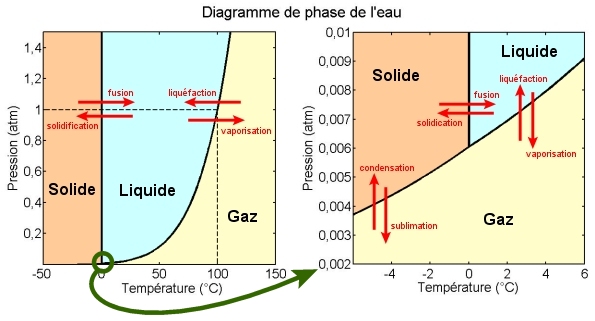
L’eau liquide, de part la valeur élevée de sa capacité thermique massique, est utilisable comme fluide caloporteur, c'est-à-dire pouvant transporter de la chaleur. Dans la plupart des cas, l’eau reste liquide : il n’y a pas de changement d’état.
Un objectif possible est de refroidir une source de chaleur, comme dans le circuit de refroidissement d’un moteur automobile (radiateur). On pense également aux réfrigérants à eau utilisés en chimie pour refroidir une partie du montage. Le refroidissement à eau est également apparu en informatique, pour évacuer la chaleur émise par certaines parties de l’ordinateur (microprocesseur, …). Dans ces exemples, l’énergie thermique emportée est souvent perdue, car elle n’est pas valorisée.
Un autre objectif est au contraire d’utiliser la chaleur véhiculée par l’eau, comme dans les systèmes de chauffage central, où de l’eau chaude pénètre dans des radiateurs, afin de chauffer un local. Il en est de même avec des capteurs solaires thermiques, dont une finalité est de chauffer de l’eau pour utilisation domestique (douche).
Dans une centrale nucléaire, l’objectif est double. Par une circulation d’eau en circuit fermé (circuit primaire), on cherche à refroidir le cœur du réacteur, et en même temps de transmettre l’énergie thermique à un autre circuit d’eau. Ce dernier met en mouvement des turbines, ce qui génère une énergie électrique.
Principe de fonctionnement d’un réfrigérateur
Quand un liquide comme l’eau passe à l’état gazeux, il « absorbe » une grande quantité d’énergie. C’est le principe des brumisateurs.
Cela concerne aussi les réfrigérateurs. Le fluide utilisé ici n’est pas l’eau, car ses propriétés physiques ne correspondent pas aux conditions d’utilisation. On emploie plutôt des fluides frigorigènes comme par exemple le 1,1,1,2-tétrafluoroéthane, un hydrofluorocarbure (HFC), utilisé sous le nom de R-134a dans l’industrie du froid. Le fonctionnement du réfrigérateur est décrit par le schéma suivant :
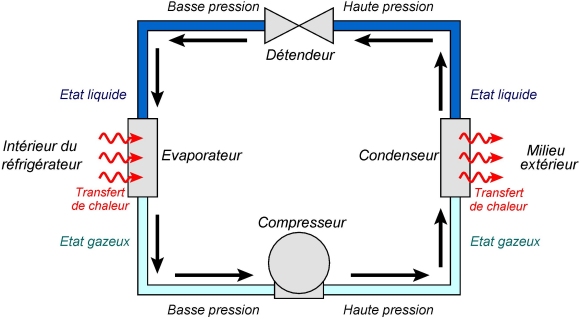
On distingue quatre parties :
• L’évaporateur : un transfert de chaleur a lieu de l’intérieur du réfrigérateur vers le fluide, qui passe alors à l’état gazeux. En conséquence, la température à l’intérieur du réfrigérateur diminue.
• Le compresseur : le fluide gazeux est mis sous pression.
• Le condenseur : grâce à la compression, le gaz peut céder plus facilement de la chaleur au milieu extérieur, au niveau de la face arrière du réfrigérateur. Le fluide repasse alors à l’état liquide.
• Le détendeur : la pression au sein du fluide liquide est diminuée, afin de faciliter sa vaporisation lors de son retour dans l’évaporateur, etc.
Cela suppose que le corps ne soit pas l’objet de réactions chimiques/nucléaires ou d’un changement d’état durant cette variation. La constante c (en
Lorsqu’il y a changement d’état de la matière, la température est constante. La variation d’énergie interne est donnée par
Les applications de ces variations d’énergie interne concernent par exemple l’utilisation de fluides caloporteurs (comme l’eau) ou les machines thermiques comme les réfrigérateurs.

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








