Les couples acide-base
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
- Identifier les couples acide-base mis en jeu.
- Représenter le schéma de Lewis et la formule semi-développée d’un acide carboxylique, d’un ion carboxylate, d’une amine et d’un ion ammonium.
- Identifier le caractère amphotère d’une espèce chimique.
- Un acide est une espèce chimique qui cède un proton.
- Une base est une espèce chimique qui capte un proton.
- Un couple acide-base s’écrit toujours en commençant par l’acide.
- Le schéma de Lewis d’une molécule s’écrit en tenant compte des doublets non liants et liants portés par chaque atome.
- Formule développée
- Schéma de Lewis
- Groupe caractéristique d’une molécule
- un acide est une espèce chimique susceptible de libérer un ou plusieurs protons H+ ;
- une base est une espèce chimique susceptible de capter un ou plusieurs protons H+.
- La molécule HCO
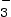 est un acide. Elle
peut en effet libérer un
protons H+ et se
transformer en CO
est un acide. Elle
peut en effet libérer un
protons H+ et se
transformer en CO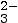 .
.
- La molécule CO
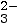 est une base. Elle
peut accepter un proton H+ et se
transformer en HCO
est une base. Elle
peut accepter un proton H+ et se
transformer en HCO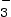 .
.
On écrit toujours l’acide en premier, séparé de la base par une barre.
- Dans le couple acide-base
H2CO3 / HCO3–,
l’acide est la
molécule H2CO3 et
la base qui lui est associée est
l’ion HCO3–.
L’acide H2CO3 se transforme en sa base conjuguée HCO3– en perdant un proton H+.
De même, la base HCO3– se transforme en son acide conjugué H2CO3 en gagnant un proton H+. - Dans le couple acide-base NH
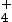 / NH3, l’acide est
l’ion ammonium NH
/ NH3, l’acide est
l’ion ammonium NH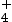 et la base qui lui
est associée est
l’ammoniac NH3.
et la base qui lui
est associée est
l’ammoniac NH3.
L’acide NH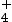 se transforme en sa
base conjuguée NH3 en
perdant un proton H+ et
inversement.
se transforme en sa
base conjuguée NH3 en
perdant un proton H+ et
inversement.
Dans le couple acide-base H3O+ / H2O, l’acide est l’ion oxonium H3O+ et la base qui lui est associée est la molécule d’eau H2O.
Dans le couple acide-base H2O / HO–, l’acide est la molécule d’eau H2O et la base qui lui est associée est l’ion hydroxyde HO–.
La molécule d’eau H2O appartient ainsi à deux couples acide-base : elle joue le rôle d’une base pour le premier couple et d’un acide pour le second couple. La molécule d’eau H2O est donc capable de capter ou de libérer un proton H+. C’est donc une espèce amphotère.
On cherche à représenter la formule développée et le schéma de Lewis d’un acide et de sa base conjuguée appartenant à deux familles : les acides carboxyliques et les amines.
Ces liaisons peuvent être simples, doubles ou triples.
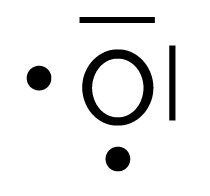
On représente un doublet liant par un tiret entre les deux atomes liés. Un doublet non liant est représenté par un tiret à côté de l’atome.
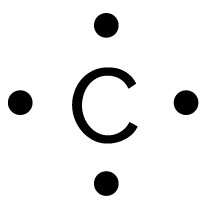
- L’atome d’oxygène O possède deux doublets non liants et effectue deux liaisons.
- L’atome de carbone C ne possède pas de doublet non liant et effectue quatre liaisons.
- L’atome d’hydrogène H ne possède pas de doublet non liant et effectue une liaison.
- L’atome d’azote possède un doublet non liant et effectue trois liaisons.
| Oxygène | Carbone | Hydrogène | Azote |
|
|
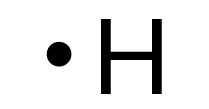
|

|
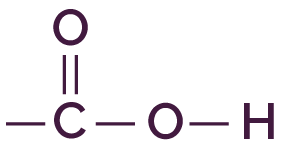
Un acide carboxylique a pour formule générale R–COOH, où R est une chaine carbonée constituée de différents atomes.
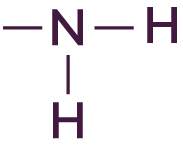
Une amine a pour formule générale R–NH2, où R est une chaine carbonée constituée de différents atomes.
Ces deux molécules sont reliées par un
couple acide-base :
R–COOH / R–COO–.
Ces deux molécules sont reliées par un
couple acide-base :
R–NH![]() / R–NH2.
/ R–NH2.
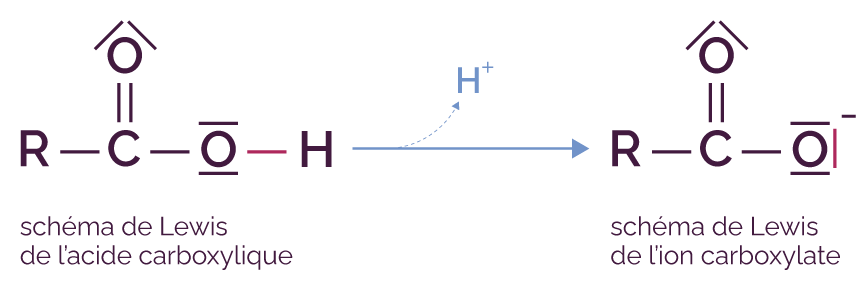
Pour passer de l’acide carboxylique ![]() à l’ion
carboxylate
à l’ion
carboxylate ![]() , l’atome
d’oxygène perd un
proton H+
et se voit attribuer une charge –.
, l’atome
d’oxygène perd un
proton H+
et se voit attribuer une charge –.
En effet, la liaison qui reliait les atomes
d’oxygène et d’hydrogène est
la mise en commun d’un électron provenant
de chaque atome.
Cette liaison se transforme en doublet non liant porté par l’oxygène. L’oxygène gagne alors un électron et porte une charge – car l’électron est chargé négativement.
Le schéma de Lewis permet de visualiser ce changement de fonction de ce doublet.
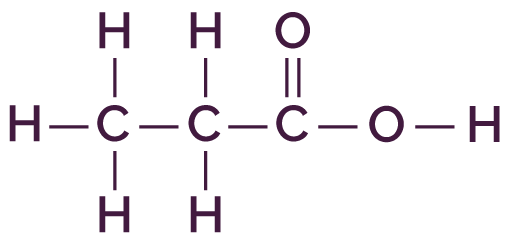
On considère le couple suivant : CH3–CH2–COOH / CH3–CH2–COO–.
L’acide de ce couple est l'acide propanoïque CH3–CH2–COOH. Il appartient bien à la famille des acides carboxyliques car il s’écrit sous la forme R–COOH avec R qui correspond au groupe CH3–CH2.
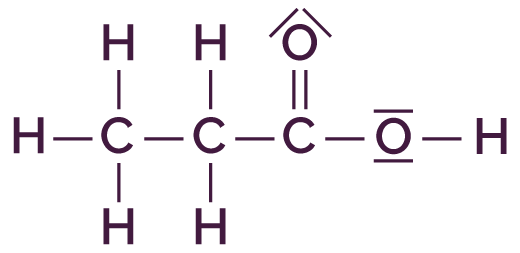
| Formule développée | Schéma de Lewis |
|
|
| Formule développée | Schéma de Lewis |
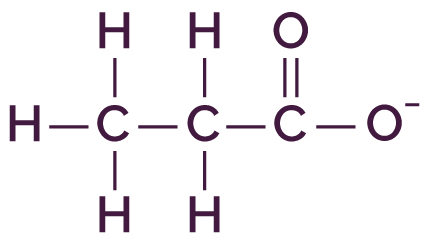 |
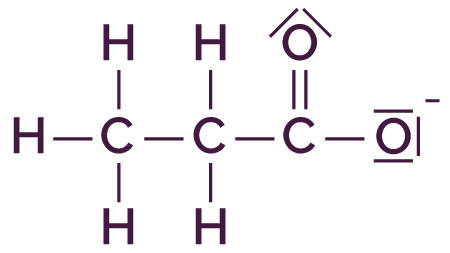
|
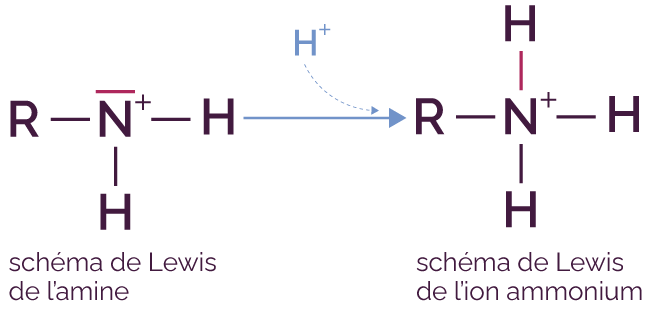
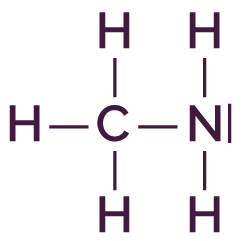
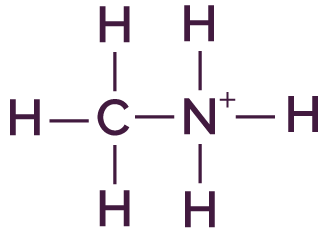
Pour passer de l’amine ![]() à l’ion ammonium
à l’ion ammonium
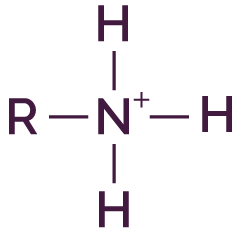 , l’atome d’azote
accepte un proton H+ et se voit
attribuer une charge +.
, l’atome d’azote
accepte un proton H+ et se voit
attribuer une charge +.
En effet, l’azote possède un doublet non
liant qui va lui permettre de se lier avec le
proton H+. Ce doublet non liant
qui correspond à deux électrons se
transforme en liaison entre N et H. Ainsi,
N perd un électron et se voit donc
attribuer une charge +.
Le schéma de Lewis permet de visualiser ce changement de fonction de ce doublet.
On considère le couple suivant : CH3NH
La base de ce couple est la méthylamine CH3NH2. Elle appartient bien à la famille des amines car elle s’écrit sous la forme R–NH2 avec R qui correspond au groupe CH3.
| Formule développée | Schéma de Lewis |
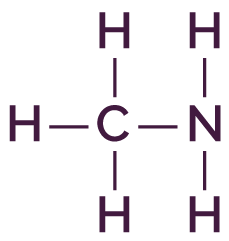
|
|
| Formule développée | Schéma de Lewis |
|

|
Le schéma de Lewis de cette molécule est identique à sa formule développée car l’atome d’azote n’a plus son doublet non liant.

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








