Déterminer une concentration à partir de la loi de Kohlrausch
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
- Exploiter la loi de Kohlrausch pour déterminer une concentration en quantité de matière ou une quantité de matière.
- Citer les domaines de validité de la loi de Kohlrausch.
Pour des espèces chimiques ioniques qui résultent par exemple de la dissolution d’un solide ionique, la loi de Kohlrausch montre que la conductivité σ (en S·m–1) de la solution est proportionnelle à la concentration en quantité de matière C du solide ionique dissous :
σ = k × C.
- Concentration en quantité de matière et quantité de matière
- Circuit électrique et conduction du courant
Une solution qui contient des ions conduit le courant.
La conductivité s’exprime en siemens par mètre (S·m–1).
On cherche à mesurer la conductivité d’une solution. On réalise le circuit suivant.
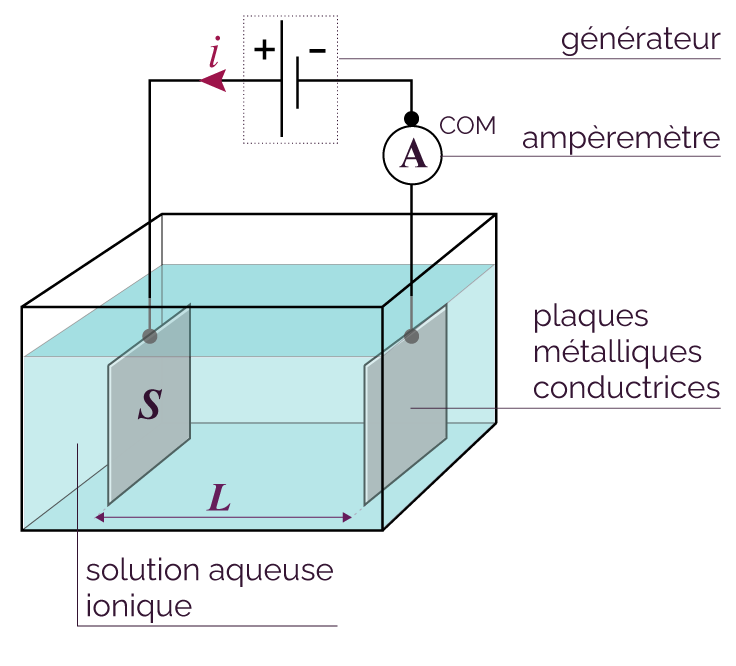
Schéma du circuit
On relie chaque plaque conductrice à une borne d’un générateur électrique. Ces plaques de surface S et séparées d'une distance L sont ensuite plongées dans une solution aqueuse ionique.
On remarque que l’ampèremètre affiche une valeur non nulle, ce qui signifie qu’un courant électrique circule. La circulation des ions au sein de la solution permet ainsi la fermeture du circuit électrique, et l’établissement d’un courant électrique i.
On étudie une solution de chlorure de sodium (Na+ + Cl–) qui contient les ions de charge positive Na+ (cations) et les ions de charge négative Cl– (Anions).
Les cations vont se diriger vers la plaque reliée à la borne négative du générateur. À l’inverse, les anions vont se diriger vers la plaque reliée à la borne positive du générateur.
C’est ainsi que les ions conduisent le courant dans une solution.
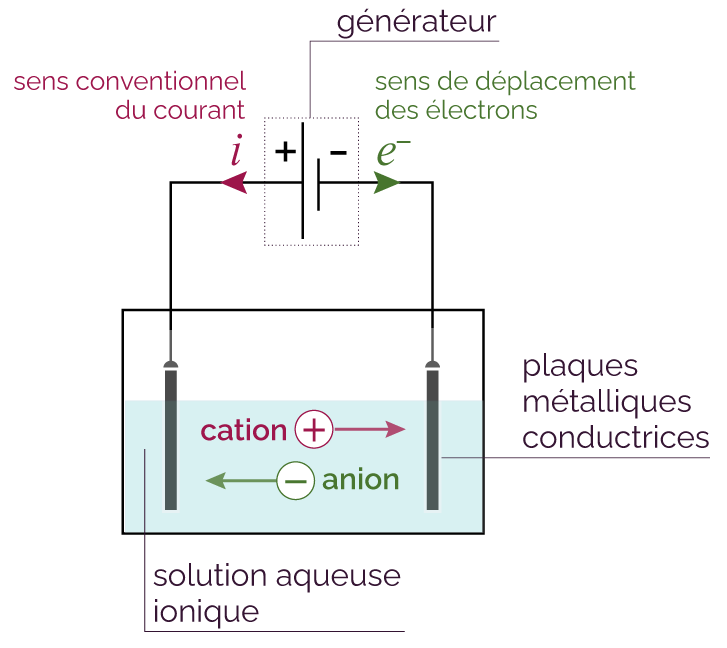
Conduction du courant dans une solution ionique
On utilise un conductimètre pour déterminer la conductivité d’une solution.
 Un conductimètre
Un conductimètre
La conductance d’une solution est
notée G et s’exprime en
siemens (S) : cette conductance correspond
à l’inverse de la
résistance R du circuit
fermé (![]() ).
).
La conductance G (en S) est proportionnelle à la conductivité σ de la solution (en S·m–1).
Le conductimètre nous donne donc accès à la conductivité σ de la solution car il mesure la conductance G qui est elle-même proportionnelle à la conductivité σ.
Ces deux grandeurs C et σ sont reliées par la relation suivante.
| σ = k × C |
avec :
|
La conductivité σ de la solution est ainsi proportionnelle à la concentration en quantité de matière C de l’espèce dissoute dans la solution.
La conductivité σ est proportionnelle à la concentration en quantité de matière C de la solution, la courbe qui représente ces deux grandeurs est donc une droite qui passe par l’origine.
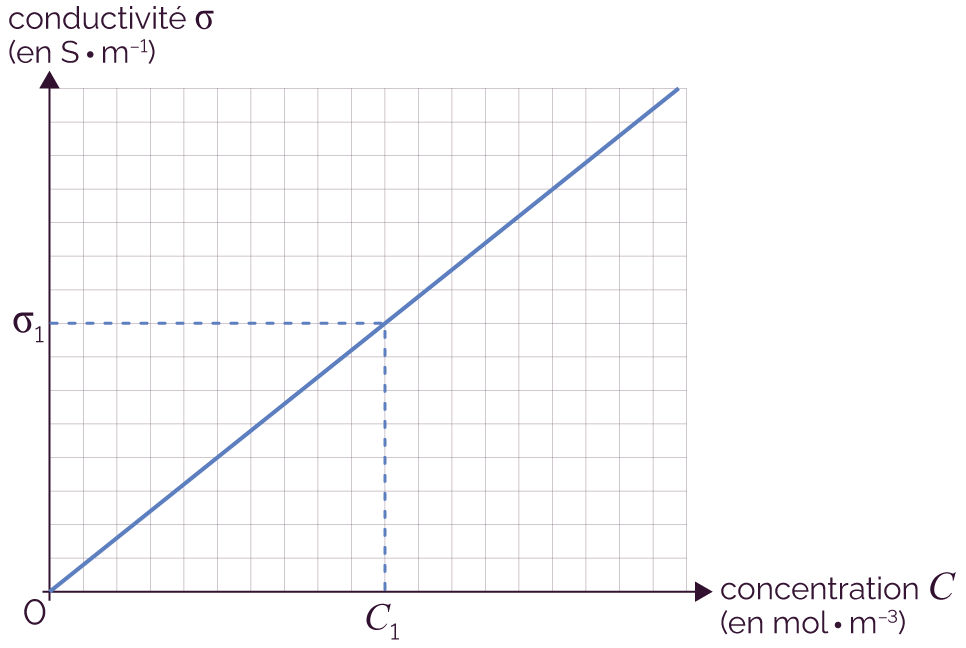
Représentation de σ en fonction de C
Pour les mesures de conductimétrie, les espèces chimiques étudiées ne doivent pas être trop concentrées ni trop diluées. De manière générale, on considère que cette technique est applicable pour des concentrations inférieures à 10 mol·m–3. Au-delà, la loi de Kohlrausch n’est plus valable.
Si on veut étudier une solution concentrée, cela impose de procéder au préalable à une dilution.
On considère une solution S de chlorure d’argent (Ag+ + Cl–) de concentration en quantité de matière C et de conductivité σ égale à 3,2 × 10–1 S·m–1.
On cherche la concentration en quantité de matière C de cette solution.
On dispose de la conductivité d’une solution S’ de concentration en quantité de matière égale à C’ = 25 mol·m–3 qui contient la même espèce (Ag+ + Cl–) : σ’ = 1,5 × 10–2 S·m–1.
- Les données relatives à la solution S sont les suivantes : σ = 3,2 × 10–1 S·m–1.
- Les données relatives à la solution S’ sont les suivantes : σ’ = 1,5 × 10–2 S·m–1 ; C’ = 25 mol·m–3.
- On applique la loi de Kohlrausch σ = k × C,
afin de calculer k pour la
solution S’ :
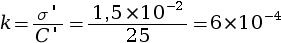 S·m2·mol–1.
S·m2·mol–1.
- On peut maintenant calculer la concentration en
quantité de matière de la
solution S :
σ = k × C soit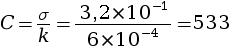 mol·m–3.
mol·m–3.

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








