Déterminer une concentration à partir de la conductance
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
Déterminer une concentration en traçant une courbe d’étalonnage à partir de mesures de conductance.
- La conductivité σ est une grandeur qui mesure la capacité d’une solution ionique à conduire le courant, elle dépend de la concentration en quantité de matière C de la solution.
- La conductance G se mesure à l’aide d’un conductimètre, elle est proportionnelle à la conductivité σ : G = k’ × C.
- La loi de Kohlrausch indique que la conductivité σ est proportionnelle à la concentration en quantité de matière C de la solution σ = k × C.
- Pour déterminer la concentration en quantité de matière C d’une solution inconnue, on peut réaliser une courbe d’étalonnage.
- Conductance et conductivité
- Loi de Kohlrausch
- Concentration en quantité de matière
Une solution qui contient des ions conduit le courant.
La conductivité s’exprime en siemens par mètre (S·m–1).
Il est possible d’avoir accès à la conductivité σ d’une solution en utilisant un conductimètre qui mesure la conductance G d’une solution.
La conductance G, qui s’exprime en siemens (S), est proportionnelle à la conductivité σ de la solution. Le conductimètre nous donne ainsi accès à la conductivité σ de la solution car il mesure la conductance G.
Pour des solutions ioniques peu concentrées (C < 10 mol·m–3), la loi de Kohlrausch montre que la conductivité σ de la solution est proportionnelle à la concentration C du solide ionique dissous. Or la conductance G est proportionnelle à la conductivité σ de la solution.
La conductance G est ainsi proportionnelle à la concentration C de l’espèce dissoute en solution.
| G = k’ × C |
avec :
|
Pour déterminer la concentration d’une solution, on utilise une courbe d’étalonnage.
Le dosage par étalonnage d’une solution nécessite l’utilisation du même matériel de chimie que celui de la dilution.
- Bécher
- Pipette jaugée
- Pipeteur ou propipette
- Fioles jaugées de volume souhaité et leurs bouchons
- Pissette d’eau distillée
Ce dosage nécessite également le matériel de mesure de la conductance G d’une solution : un conductimètre.
On dispose au laboratoire :
- d’une solution S contenant une espèce
ionique en solution de concentration
connue C :
le chlorure de sodium (Na+ (aq) + Cl– (aq)), C = 10 mol·m–3 ; - d’une solution S’ de concentration C’ inconnue contenant les mêmes espèces ioniques (Na+ (aq) + Cl– (aq)), qui est moins concentrée que la solution S.
On souhaite déterminer la concentration C’ de la solution S’. On réalise tout d’abord des dilutions successives de la solution S puis on trace une courbe d’étalonnage.
Il y a une relation de proportionnalité entre la concentration en quantité de matière C de l’espèce ionique dissoute et la conductance G de la solution : G = k’ × C. Le coefficient de proportionnalité k’ entre ces deux grandeurs n’est toutefois à priori pas connu.
On mesure ensuite la conductance G de ces solutions. En représentant graphiquement l’évolution de G en fonction de C, les points expérimentaux obtenus s’alignent selon une droite qui passe par l’origine, dont la pente est égale à k’. Cette droite est la courbe d’étalonnage.
On réalise des dilutions successives de la solution S pour déterminer la concentration C’.
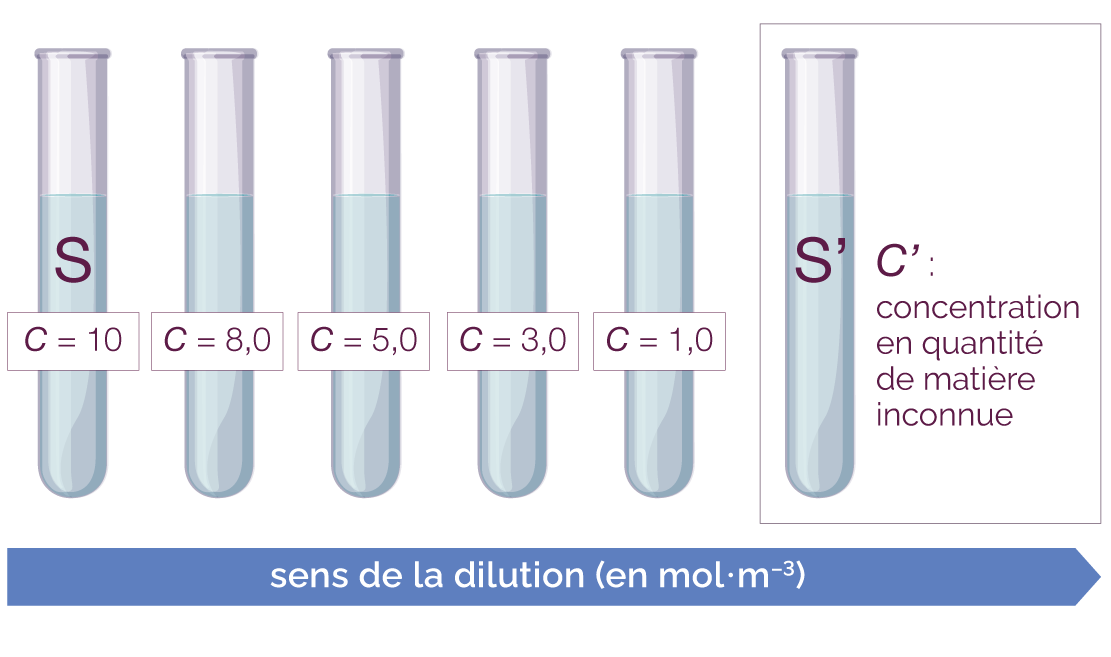
Réalisation de dilutions successives
pour déterminer la concentration de la solution S’
Pour obtenir une valeur précise de la concentration en quantité de matière C', on réalise une courbe d’étalonnage (courbe de référence).
- On utilise un conductimètre pour
réaliser cette courbe : il s’agit de
mesurer la conductance G de chaque solution
diluée dont on connait la concentration.
Concentration (en mol·m–3) 1,0 3,0 5,0 8,0 10 Conductance (en mS) 0,8 2,6 4,4 7,0 8,8 - On trace la courbe de la
conductance G
en fonction de la concentration en quantité de
matière C.
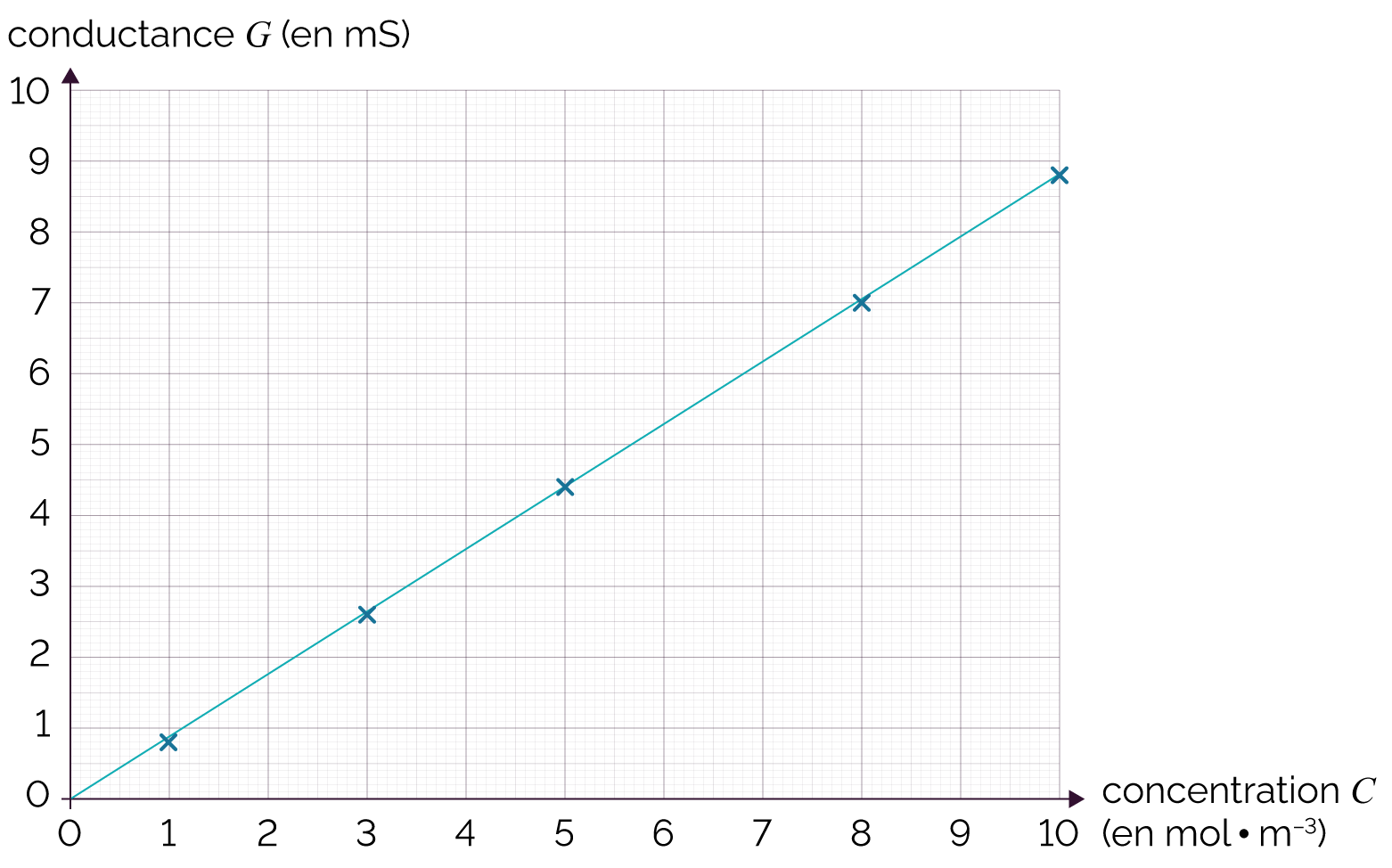
Courbe d’étalonnage des solutions étalons
On mesure ensuite la conductance G de la solution S’ et on reporte sa valeur sur la courbe d’étalonnage.
L’abscisse du point correspond à la concentration C’ recherchée.
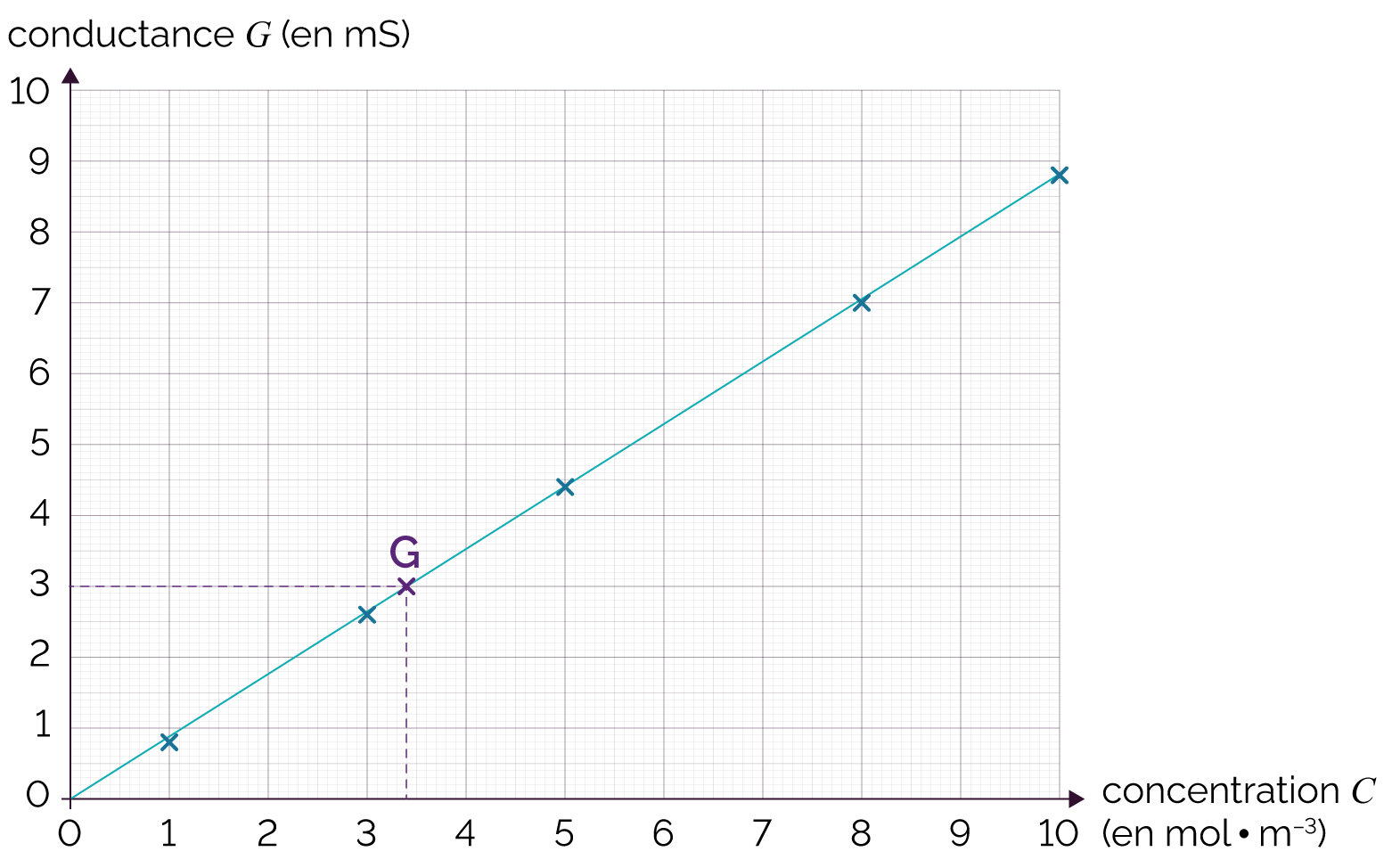
Courbe d’étalonnage des solutions étalons
On trouve par exemple G’ = 3,0 mS. On lit ainsi sur ce graphique que notre solution S’ a une concentration C’ = 3,4 mol·m–3.
Il existe une autre méthode pour calculer la concentration en quantité de matière C’ : on calcule la valeur de la constante k’.
On choisit deux points A et B sur la droite, ne correspondant pas forcément aux points expérimentaux.
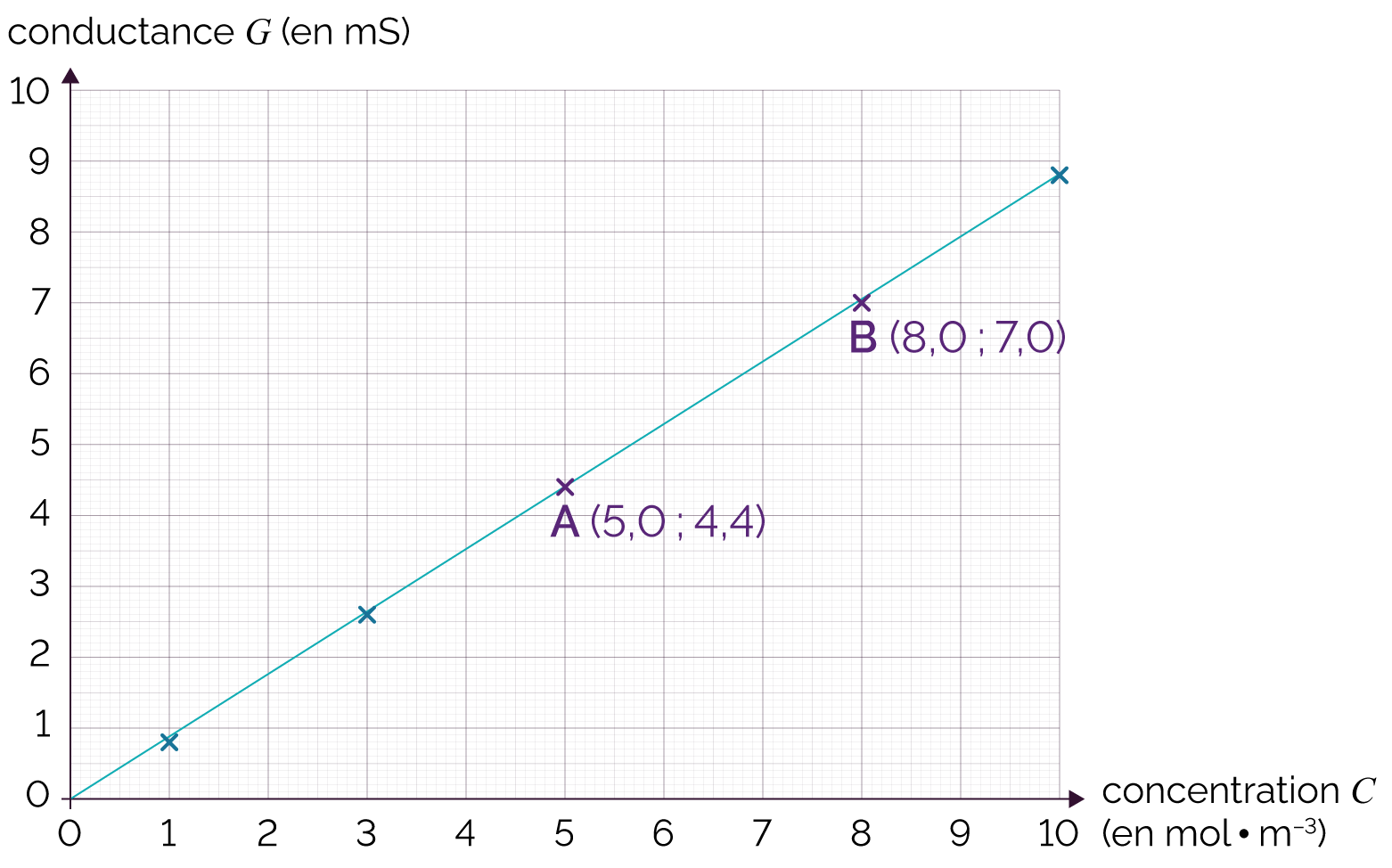
On estime ensuite le coefficient directeur de la
droite, c'est-à-dire k’, avec la
relation suivante : ![]() .
.
Dans notre exemple, cela donne :
![]() mS·m2·mol–1.
mS·m2·mol–1.
En mesurant la conductance G’ de la solution S’ étudiée, on en déduit sa concentration C’ en utilisant la valeur expérimentale de k’ dans la relation G’ = k’ × C’.
Dans notre exemple, on a mesuré une conductance
G’ = 3,0 mS,
on en déduit que la
concentration C’
recherchée vaut : ![]() mol·m–3.
mol·m–3.
On retrouve approximativement la valeur lue sur le graphique.

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








