Savons : propriétés, applications et illustrations
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
- Expliquer le caractère amphiphile et les propriétés lavantes d’un savon à partir de la formule semi-développée de ses entités.
- Illustrer les propriétés des savons.
- Un savon est un mélange de carboxylate et de sodium (ou de potassium).
- L’ion carboxylate possède une partie hydrophile et une partie lipophile : il est amphiphile.
- L’ion carboxylate forme une monocouche autour d’une salissure d’origine organique et une bicouche autour d’une salissure d’origine minérale.
- L’ion
- La formule semi-développée
|
R—CO2Na |
avec :
|
Une chaine carbonée non ramifiée possède une formule brute de la forme CnH2n + 1 où les atomes de carbone réalisent tous 4 liaisons simples.
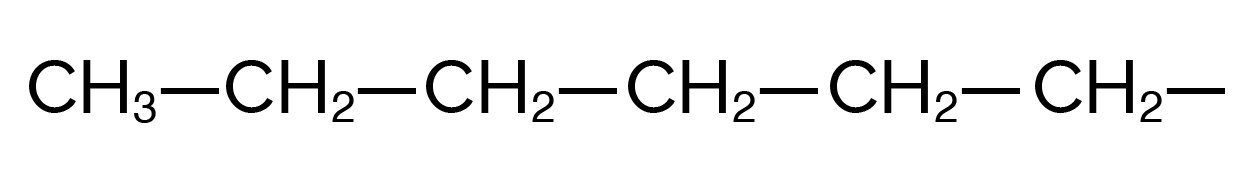
Chaine carbonée non ramifiée avec 6 atomes de carbone
Un savon est composé d’un ion
carboxylate R—CO![]() et d’un ion
sodium Na+
(ou potassium K+).
et d’un ion
sodium Na+
(ou potassium K+).
L’oléate de sodium de formule C17H33CO
Son modèle moléculaire est le suivant.
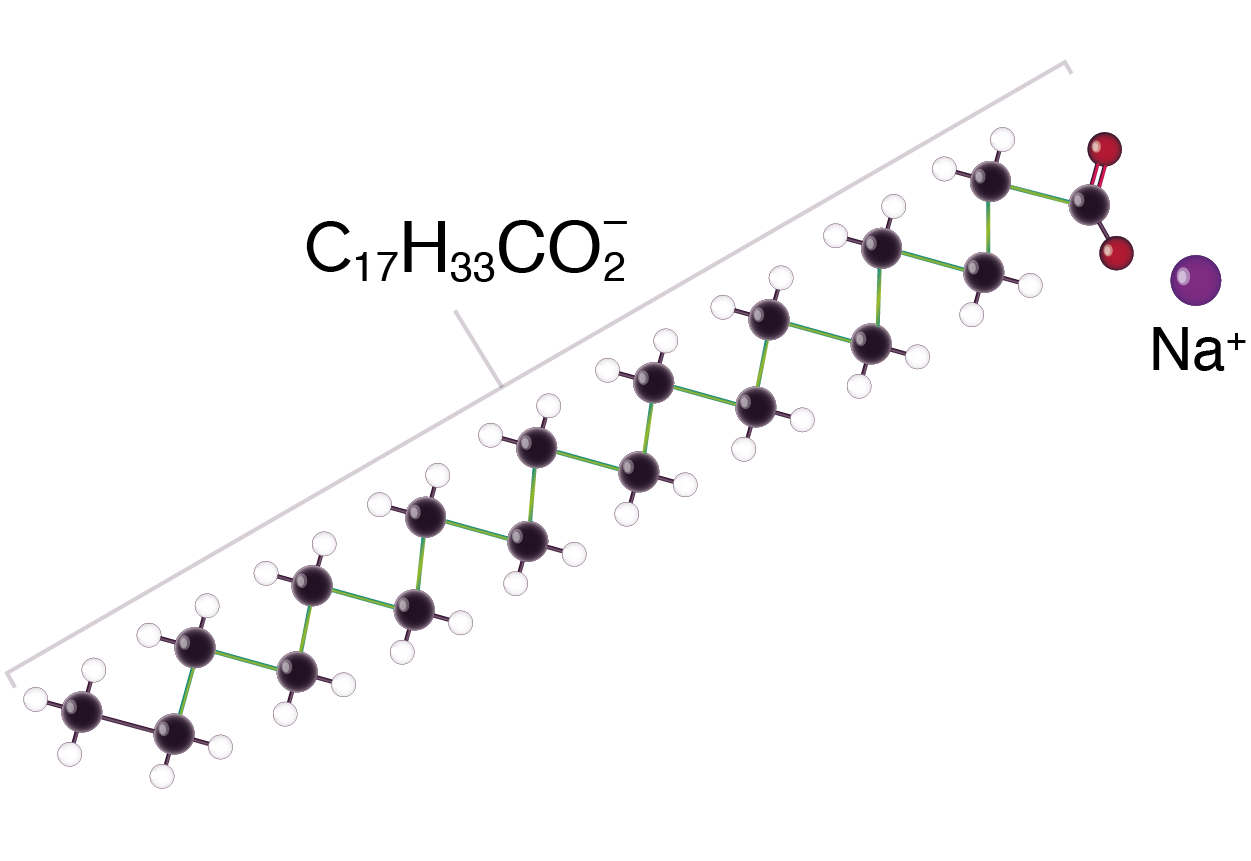
Exemple de modèle moléculaire d’un savon
Dans un modèle moléculaire, une boule noire correspond à un atome de carbone, une boule blanche correspond à un atome d’hydrogène, et une boule rouge correspond à un atome de d’oxygène.
Les ions carboxylate R—CO![]() qui sont contenus dans les savons
possèdent deux parties : l’une est
hydrophile (et lipophobe) et l’autre
est lipophile (et hydrophobe).
qui sont contenus dans les savons
possèdent deux parties : l’une est
hydrophile (et lipophobe) et l’autre
est lipophile (et hydrophobe).
- La partie CO
 est hydrophile : CO
est hydrophile : CO est chargée négativement, cette
partie attire donc les molécules d’eau,
qui sont des molécules polaires.
est chargée négativement, cette
partie attire donc les molécules d’eau,
qui sont des molécules polaires.
- La partie R est lipophile : R est électriquement neutre car elle est uniquement composée d’atomes de carbone et d’hydrogène, cette partie attire donc les corps gras qui sont des molécules organiques à longue chaine carbonée et qui sont des molécules apolaires.
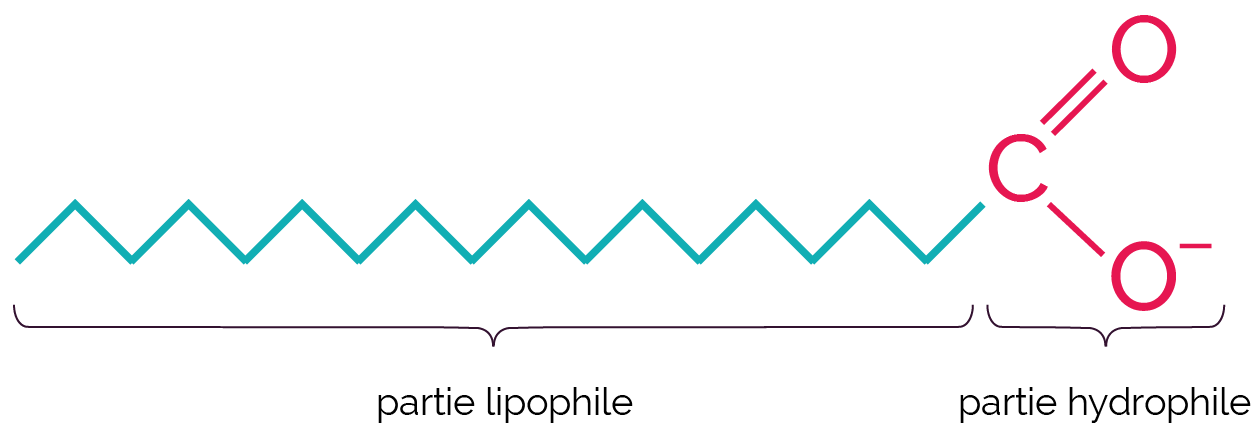
Structure de l’ion carboxylate
- Hydrophile signifie « qui aime l’eau » et hydrophobe signifie « qui n’aime pas l’eau ».
- Lipophile signifie « qui aime la graisse » (ou les corps gras) et lipophobe signifie « qui n’aime pas la graisse » (ou les corps gras).
Les ions carboxylate sont des espèces amphiphiles, c’est-à-dire qu’elles ont une partie attirée par les molécules d’eau et une autre partie attirée par les molécules organiques telles que les corps gras (huile, beurre, etc.).
On peut aussi les représenter de manière schématique de la façon suivante.

Représentation de l’ion carboxylate
Le savon possède un pouvoir lavant : il peut éliminer les salissures de différentes sortes.
Les salissures peuvent avoir deux origines différentes : organiques (huiles, corps gras, graisses, etc.) ou minérales (terre, fruits, etc.).
- Les ions carboxylate interagissent avec les salissures d’une manière différente selon leur nature : soit par leur partie lipophile, soit par leur partie hydrophile.
- Les ions carboxylate se regroupent ensuite sous forme d’agrégats autour des salissures, ce qui permet leur élimination.
Comme le groupe carboxylate CO2 est chargé négativement, il s’entoure de molécules d’eau polaires ; celles-ci sont en effet polaires et sont donc sensibles à l’interaction électrostatique (elles approchent la partie qui porte la charge +q, c’est-à-dire les atomes d’hydrogène).
Avec une salissure d’origine organique (graisse, beurre, huile, etc.), il se forme une monocouche de savon, c’est-à-dire qu’une seule couche d’ions carboxylate entoure la salissure.
La partie hydrophile est au contact de la salissure et la partie hydrophile au contact de l’eau.
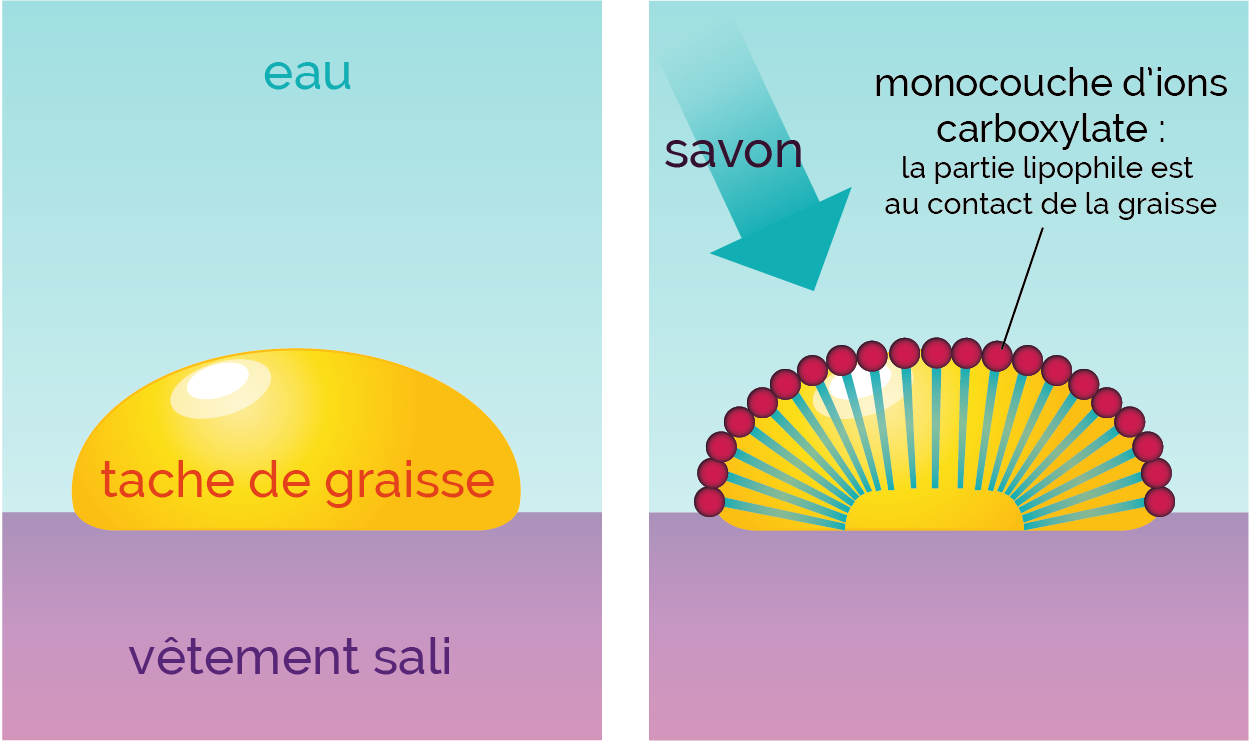
Formation d’une monocouche
Avec une salissure d’origine minérale, il se forme une bicouche de savon, c’est-à-dire une double couche d’ions carboxylate entoure la salissure.
La partie lipophile est au contact de la salissure puis, pour la seconde couche, la partie hydrophile est au contact de l’eau.
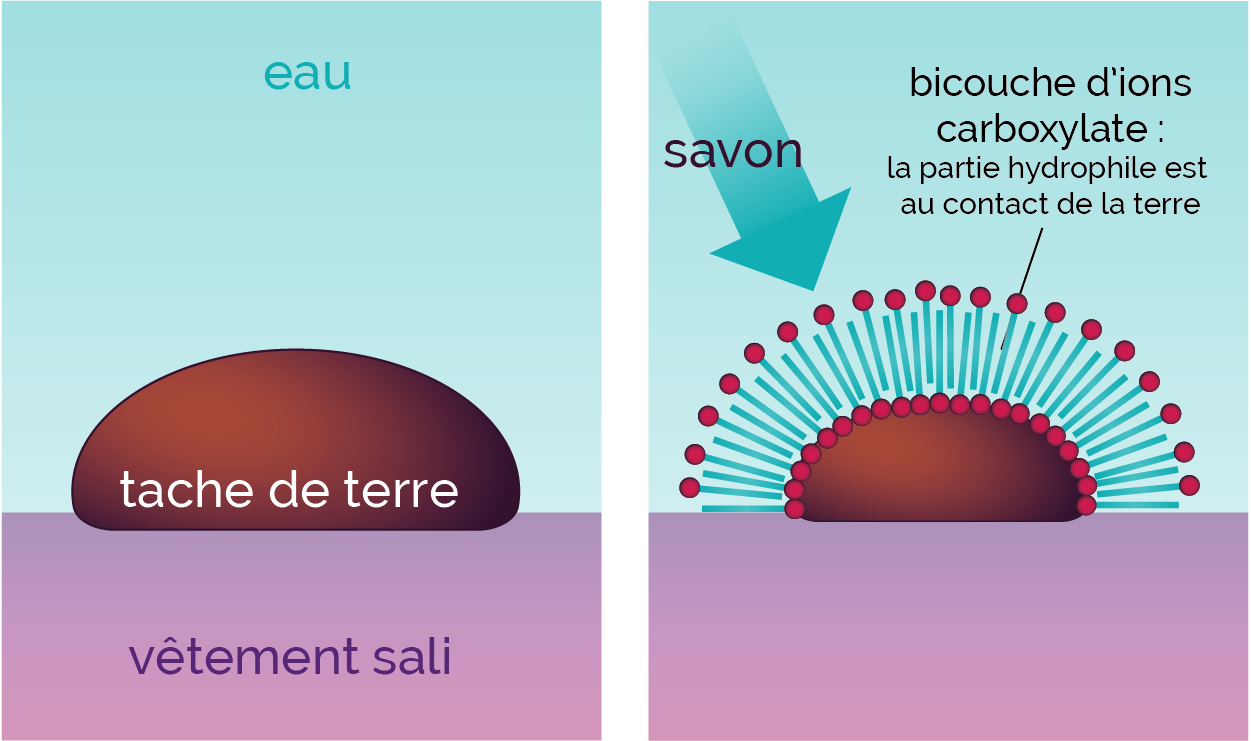
Formation d’une bicouche
On dit que le savon est un tensioactif car il permet de solubiliser dans l’eau des substances qui ne le sont pas au départ (graisse, huile, corps gras, etc.).

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








