Calculer l'énergie molaire d'une réaction de combustion
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
Estimer l’énergie molaire de réaction pour une combustion, à partir des énergies des liaisons.
- L’énergie molaire Eréaction libérée au cours d’une réaction est égale à la différence entre la somme des énergies de liaisons des réactifs et la somme des énergies de liaisons des produits.
- L’énergie molaire de liaison Eliaison d’une molécule est l’énergie nécessaire à apporter à une molécule pour casser ses liaisons.
- L’énergie molaire de combustion est l’énergie nécessaire pour réaliser la combustion complète d’une mole de combustible. Cette énergie est toujours négative car une combustion libère de l’énergie.
- Équation de la réaction de combustion
- Coefficients stoechiométriques
Au cours d’une réaction chimique, des liaisons se forment ou se « cassent » entre les atomes et les molécules pour former les produits de la réaction.
Quelle est l’énergie mise en jeu lors de la formation et la rupture des liaisons atomiques ou moléculaires ?
Le comburant le plus courant est le dioxygène O2.
Pour les combustions rapides et assez chaudes, la réaction s’accompagne d’une flamme avec émission d’énergie lumineuse.
La combustion ne se produit pas spontanément, elle a besoin d’être activée par une énergie : il s’agit d’un apport de chaleur, sous forme d’étincelles ou autre.
À l’échelle microscopique, des liaisons chimiques des réactifs sont détruites lors de la combustion, ce qui libère les atomes. D’autres liaisons vont alors se former pour lier ces atomes et donner les molécules issues de la combustion (les produits).
Une énergie molaire de liaison est une énergie de liaison par unité de mole. Elle s’exprime en joule par mole (J·mol−1).
On considère la molécule de méthanol COH4.
L’énergie molaire de la liaison C—H est EC—H = 415 J·mol−1 et celle de la liaison O—H est EO—H = 463 J·mol−1.
L’énergie à apporter à cette molécule pour casser la liaison C—H est moins importante que pour casser la liaison O—H.
On écrit la formule développée du méthanol :
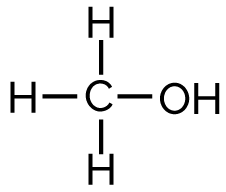
Le méthanol est constitué de 3 liaisons C—H, de 1 liaison C—O et de 1 liaison O—H.
Cette énergie molaire correspond à la différence d’énergie entre les énergies de liaisons avant et après combustion.
Pour comprendre à quoi correspond l’énergie molaire de réaction, il faut imaginer un processus au cours duquel toutes les molécules des réactifs se dissocient en atomes isolés à l’état gazeux, à partir desquels les molécules des produits se reforment.
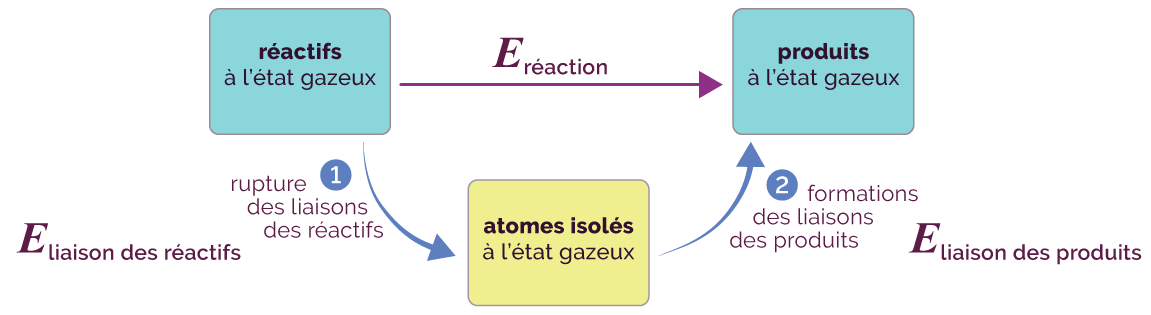
Processus de transformation de réactifs en produits
- Les liaisons des réactifs se rompent, ce qui libère de l’énergie.
- Les liaisons des produits se forment à partir des atomes isolés (issus des ruptures de liaisons des produits), ce qui consomme de l’énergie.
L’énergie molaire de réaction Eréaction qui est libérée au cours de la réaction est donc égale à la différence des énergies de liaison de tous les réactifs (liaisons rompues) et des énergies de liaison des produits (liaisons formées).
|
|
avec :
|
Cette énergie est toujours négative car une combustion libère de l’énergie (elle est exothermique). Cela signifie que l’énergie fournie par la rupture des liaisons des réactifs est moins importante que l’énergie consommée par le système pour former les liaisons des produits.
L’énergie libérée lors d’une combustion dépend de la quantité de combustible. Pour la calculer, il faut donc multiplier l’énergie molaire de réaction (pour 1 mole) par la quantité de matière du combustible.
Pour calculer l’énergie molaire d’une réaction, on suit la méthode suivante.
- Étape 1 : Écrire l’équation de la réaction et l’équilibrer.
- Étape 2 : Donner les formules développées des réactifs et des produits.
-
Étape 3 : Identifier les
ruptures et formations de liaisons.
Pour chaque réactif et produit, on identifie les liaisons qui les constituent. -
Étape 4 : Calculer les
énergies molaires de liaisons.
On calcule les énergies de toutes les liaisons qui constituent les réactifs et les produits. -
Étape 5 : Appliquer la
formule
 .
.
On souhaite calculer l’énergie molaire Eréaction qui est produite au cours de la combustion complète du méthane CH4 à l’état gazeux.
- EC—H = 415 kJ·mol−1 ;
- EO=O = 498 kJ·mol−1 ;
- EC=O = 798 kJ·mol−1 ;
- EO—H = 463 kJ·mol−1.
L’équation associée à cette réaction est :
CH4(g) + 2 O2(g) → CO2(g) + 2 H2O(g).
Le visuel suivant montre le processus d’isolement des atomes dans cette réaction.
Les atomes qui constituent les réactifs de la réaction vont se retrouver isolés suite à la rupture des liaisons Ⓘ. Ces atomes isolés vont permettre la formation des produit de la réaction ②.
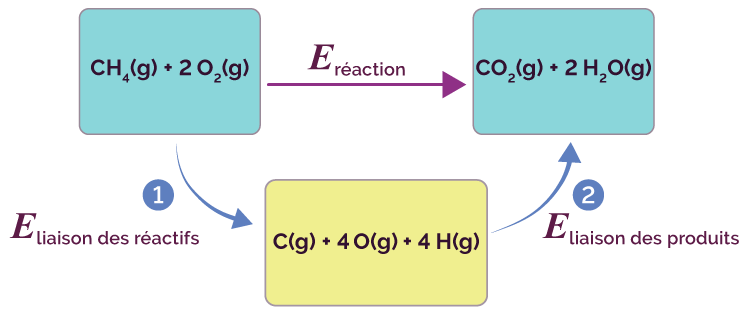
Rupture et formation de liaisons dans une réaction chimique
On écrit la formule développée de tous les constituants de cette équation.
| Réactifs | Produits | ||
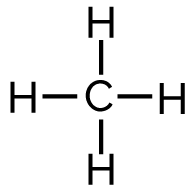 Méthane CH4 |
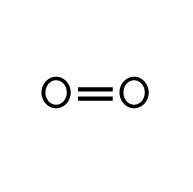 Dioxygène O2 |
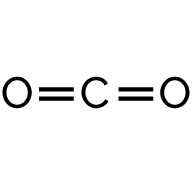 Dioxyde de carbone CO2 |
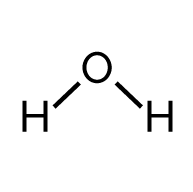 Eau H2O |
Au cours de cette réaction, des liaisons vont se rompre et d’autres se former.
- Rupture de 4 liaisons C—H dans 1 molécule de méthane CH4.
- Rupture de la double liaison O=O dans 2 molécules de dioxygène O2.
- Formation de 2 doubles liaisons C=O dans la molécule de CO2.
- Formation de 2 liaisons O—H dans 2 molécules d’eau H2O.
On calcule les énergies de toutes les liaisons qui constituent les réactifs et les produits.
- La rupture de 4 liaisons C—H (4 × 1) fournit l’énergie molaire Eliaison C—H = 4 × EC—H.
- La rupture de 2 doubles liaisons O=O (1 × 2) fournit l’énergie molaire Eliaison O=O = 2 × EO=O.
- La formation de 2 doubles liaisons C=O (2 × 1) consomme l’énergie molaire Eliaison C=O = 2 × EC=O.
- La formation de 4 liaisons O—H (2 × 2) consomme l’énergie molaire Eliaison O—H = 4 × EO—H.
On applique la formule :
![]()
On obtient ainsi :
Eréaction = (4 × EC—H + 2 × EO=O) − (2 × EC=O + 4 × EO—H)
Eréaction = (4 × 415 + 2 × 498) − (2 × 798 + 4 × 463)
Eréaction = −792 kJ·mol−1 = −792 × 103 J·mol−1.
Eréaction < 0, ce qui est normal car une réaction de combustion est toujours exothermique.

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








