Estimer le pouvoir calorifique massique d'une combustion
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
Mettre en œuvre une expérience pour estimer le pouvoir calorifique massique d’un combustible.
- Il faut effectuer un bilan d’énergie entre tous les constituants de la réaction pour calculer l’énergie libérée par un combustible.
- Il faut tenir compte de la masse de combustible qui a subi la combustion pour en déduire le pouvoir calorifique massique permettant d’obtenir la chaleur de combustion.
- Le pouvoir calorifique massique PC d’une combustion est
l’énergie E que l’on peut
récupérer lorsque 1 kg de combustible
réagit complètement avec le dioxygène
de l’air. Il s’exprime par :
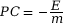 .
.
- Équation de la réaction de combustion
- Coefficients stœchiométriques
Il se note PC et s’exprime en kilojoule par kilogramme (kJ·kg−1).
Le pouvoir calorifique correspond à une énergie E libérée par kilogramme de combustible.
La réaction étant exothermique (elle dégage de la chaleur), le pouvoir calorifique est une grandeur négative.
D’autres unités pour le PC sont possibles, telles que J·kg−1, MJ·kg−1, etc.
Le pouvoir calorifique massique s’exprime par la relation suivante.
|
|
avec :
|
Le signe « − » signifie qu’il y a une perte d’énergie du système suite à sa combustion : l’énergie E est négative car elle est libérée par le système. Le pouvoir calorifique est quant à lui positif.
La combustion d’un morceau de sucre de 5,0 g libère 49,4 kJ.
Le pouvoir calorifique de cette combustion est alors
On a donc :
PC = 9,9 × 103 kJ·kg−1.
On souhaite ici déterminer le pouvoir calorifique PC de combustion (aussi appelé chaleur de réaction) de la paraffine, de formule brute C25H52, contenue dans une bougie.
La réaction de combustion de la paraffine s’écrit :
C25H52(s) + 38 O2(g) → 25 CO2(g) + 26 H2O(l)
Il faut pour cela chauffer un récipient rempli d’eau grâce à la réaction de combustion (exothermique) de la paraffine contenue dans une bougie.
Le montage pour calculer le pouvoir calorifique massique de la paraffine nécessite l’utilisation du matériel de chimie suivant.
|
|
On utilise le protocole suivant.
-
Peser la canette et la fixer sur la
potence.
On pèse la canette et on note sa valeur : mcan = 14,5 g.
À l’aide d’une pince, on attache la canette vide à la potence. -
Introduire l’eau dans la canette.
On introduit m = 200 g d’eau (soit 200 mL mesurés à l’aide d’une éprouvette graduée) dans la canette. -
Relever la température initiale de
l’eau.
On plonge un thermomètre dans la canette et on relève la température dans l’eau : θ1 = 10 °C. -
Peser la bougie et son support et la placer sous
la canette.
On place une bougie sur une soucoupe et on pèse la masse de l’ensemble : m1 = 35 g (cette valeur est à adapter selon le matériel utilisé).
On place ensuite la bougie de sorte que celle-ci soit à environ 3 cm du fond de la canette. -
Allumer la bougie.
On allume la bougie et on agite continuellement l’eau contenue dans le récipient à l’aide d’une baguette en verre pour homogénéiser la température.
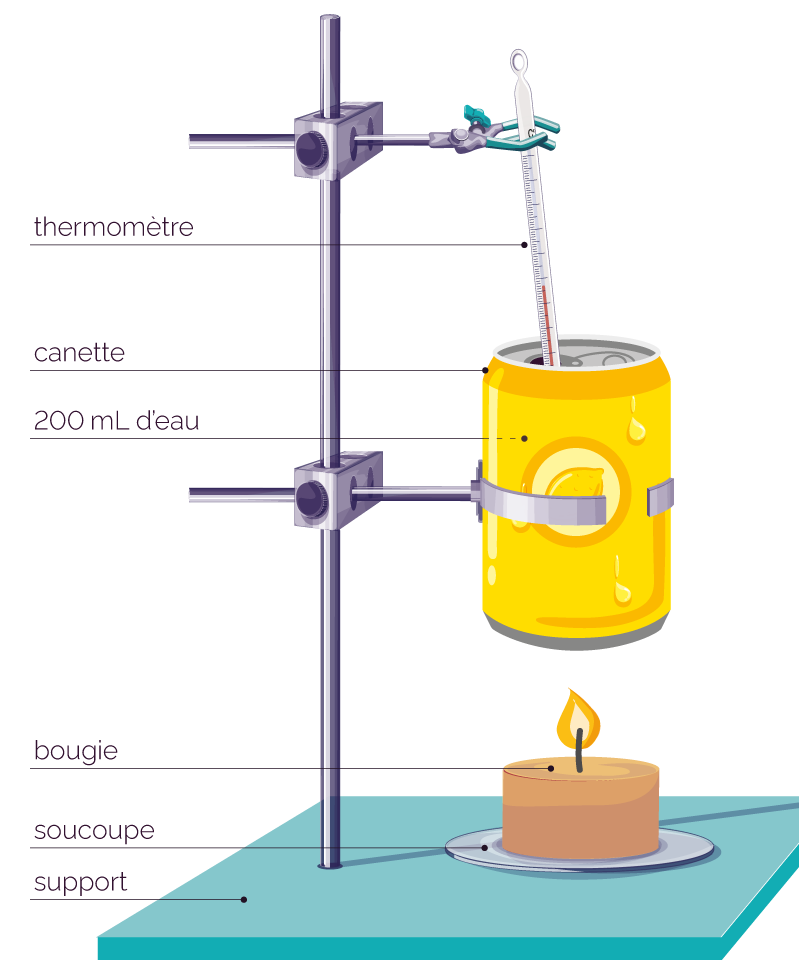
Schéma du montage -
Éteindre la bougie et relever la
température finale de l’eau.
Lorsque la température a augmenté de 10 °C, on éteint la bougie pour arrêter la combustion et on note la température finale de l’eau contenue dans la canette : θ2 = 20 °C. -
Peser la bougie et son support.
On pèse l’ensemble {bougie + coupelle} et on obtient m2 = 34,9 g.
On suppose que l’énergie libérée par la combustion de la bougie Ebougie est entièrement utilisée pour chauffer l’eau et le métal qui constitue la canette (il n’y a pas de pertes vers l’extérieur). L’eau a alors emmagasiné l’énergie Eeau et la canette l’énergie Ecanette pour élever chacune leur température. La bougie a perdu de l’énergie pour chauffer l’eau et la canette.
On peut donc écrire : Ebougie = −(Ecanette + Eeau).
On sait que la chaleur emmagasinée E par un élément s’exprime ainsi.
|
|
avec :
|
- La formule
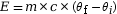 n’est pas à connaitre.
n’est pas à connaitre.
- c est l’énergie nécessaire pour augmenter la température de 1 g d’un corps de 1 degré Kelvin (K).
On a donc :
- Ecan = mcan × ccan × (θf − θi) avec ccan = 0,90 J·g−1·K−1 et (θf − θi) = 10 °C = 283 K car la température a augmenté de 10 °C au cours de l’expérience.
- Eeau = meau × ceau × (θf − θi) avec ceau = 4,187 J·g−1·K−1 et (θf − θi) = 10 °C = 283 K car la température a augmenté de 10 °C au cours de l’expérience.
On en déduit donc l’énergie
libérée par la bougie :
Ebougie = −(Ecanette + Eeau)
soit :
Ebougie = −(mcan × ccan × (θf − θi) + meau × ceau × (θf − θi))
Ebougie = −(14,5 × 0,90 × 283 + 0,2 × 4,187 × 283)
Ebougie = −3,93 kJ = −3,93 × 103 J
Après avoir déterminé l’énergie libérée par la bougie lors de sa combustion, on peut calculer le pouvoir calorifique PC de la bougie en utilisant la formule suivante.
|
|
avec :
|
La masse m de bougie qui a subi la combustion est m = m1 − m2 = 35 − 34,9 = 0,1 g.
On a donc ![]() kJ·g−1.
kJ·g−1.
L’écart relatif d’une grandeur X se mesure par rapport à une valeur de référence.
Il se note e et s’exprime par :
L’écart relatif n’a pas d’unité et peut s’exprimer en %.
En général, lorsque sa valeur est inférieure à 5 %, on conclut que l’expérience s’est déroulée correctement et que la valeur trouvée est proche de la valeur attendue.
Le pouvoir calorifique théorique de la paraffine est PCthéorique = 40,0 kJ·g−1.
Cela signifie que l’énergie qui peut être récupérée lors de la combustion de 1 kg de paraffine est en théorie de Q = 40,0 kJ·g−1.
On calcule l’écart relatif e entre ces 2 mesures :
![]()
![]() soit 2 %.
soit 2 %.
La valeur trouvée expérimentalement est proche de la valeur théorique mais il subsiste tout de même une différence.
Cette différence peut s’expliquer par quelques paramètres d’erreurs dont il faut tenir compte :
- les fuites thermiques sont des pertes énergétiques non prises en compte ici puisque la bougie allumée ne chauffe pas que la canette et l’eau : une partie de sa chaleur est « perdue » en chauffant l’air ambiant ;
- la masse m de la bougie ne contient pas 100 % de paraffine : d’autres constituants de la bougie ont peut-être subi d’autres réactions de combustion parasites ;
- l’homogénéisation de la température a peut-être été insuffisante.

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








