Calculer le rendement d'une synthèse
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
Déterminer, à partir d’un protocole et de données expérimentales, le rendement d’une synthèse.
- Le rendement d’une synthèse se calcule en faisant le rapport entre la masse de produit obtenue suite à l’expérience et la masse de produit que l’on devrait obtenir théoriquement.
- Le rendement est un nombre inférieur à 1, dépendant des conditions de manipulation et de la réaction.
- Protocole de synthèse d’une réaction
- Calcul de la quantité de matière
- Équation de la réaction
- Tableau d'avancement
Le rendement est une grandeur qui nous renseigne sur l’efficacité d’une réaction chimique.
On l’écrit de la manière suivante.
|
|
avec :
|
- Le rendement est un nombre compris entre 0 et 1.
- Il est sans unité et peut s’exprimer en pourcentage lorsqu’on le multiplie par 100.
- Il peut aussi être calculé à partir des quantités de matière.
Le rendement a une valeur obligatoirement inférieure à 1. Après avoir réalisé l’expérience, on n’arrive en effet jamais à obtenir autant de produit que ce qui a été prévu par les calculs théoriques.
La valeur du rendement dépend de plusieurs facteurs.
- La réaction n’est pas totale : une partie des réactifs n’est pas transformée.
- Les pertes au cours des diverses étapes (lavage, séchage, recristallisation, vapeurs échappées au cours du reflux, etc.).
- Les erreurs de manipulations (mauvais séchage, oubli de faire la tare, etc.).
- Les réactions parasites possibles lors de l’expérience.
On considère la réaction suivante.
|
|
avec :
|
Pour calculer le rendement de cette réaction, on va s’intéresser au produit C de la réaction.
Il faut d’un côté déterminer la masse expérimentale du produit C, et de l’autre calculer la masse théorique qu’il faudrait idéalement obtenir. On peut enfin calculer le rendement de la réaction.
On réalise la synthèse du produit C en respectant les quantités des réactifs.
Une fois la manipulation terminée, le produit C est obtenu dans un milieu réactionnel qui contient des espèces liquides.
S’il s’agit d’un solide, il faut l’isoler en effectuant :
- une filtration pour récupérer uniquement l’espèce solide ;
- un lavage pour éliminer toute trace des autres éléments de la réaction ;
- un séchage en récupérant le solide dans une coupelle et en l’introduisant dans une étuve à 100 °C.
S’il s’agit d’un liquide, il faut l’isoler en effectuant :
- une extraction liquide-liquide ;
- un lavage pour éliminer toute trace des autres éléments de la réaction ;
- une purification avec une distillation fractionnée.
On pèse ensuite le produit C obtenu, ce qui permet d’obtenir sa masse expérimentale.
On établit le tableau d’avancement de la réaction en remplissant les états initial et intermédiaire.
On détermine le réactif limitant, puis on calcule l’avancement maximal et on remplit l’état final du tableau d’avancement.
On calcule la masse maximale, qu’on peut obtenir à partir du tableau d’avancement.
Pour calculer le rendement de la réaction,
il faut utiliser la formule ![]() .
.
On souhaite calculer le rendement de la synthèse de l’indigo, de formule C16H10N2O2.
L’équation de cette synthèse s’écrit :
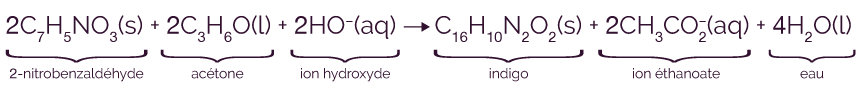
Pour réaliser cette synthèse, on utilise les éléments suivants.
- m(C7H5NO3) = 50 g ;
- V(C3H6O) = 5,0 mL ;
-
V = 4,0 mL
d’une solution d’hydroxyde de sodium
(Na+(aq) + HO−(aq)) à la concentration CB = 5,0 mol·L−1.
Une fois la réaction terminée :
- on filtre le milieu réactionnel pour récupérer l’indigo ;
- on lave le filtrat à l’eau distillée, puis avec l’éthanol. Le lavage de l’indigo à l’éthanol permet d’éliminer les traces de 2-nitrobenzaldéhyde ;
- on récupère l’indigo dans une coupelle et on le sèche dans une étuve à 100 °C : on obtient l’indigo pur ;
- on pèse l’indigo obtenu : mexp = 1,32 g.
|
Données
|
On utilise un tableau d’avancement pour calculer la masse théorique d’indigo qu’on aurait obtenu si la réaction avait été totale.
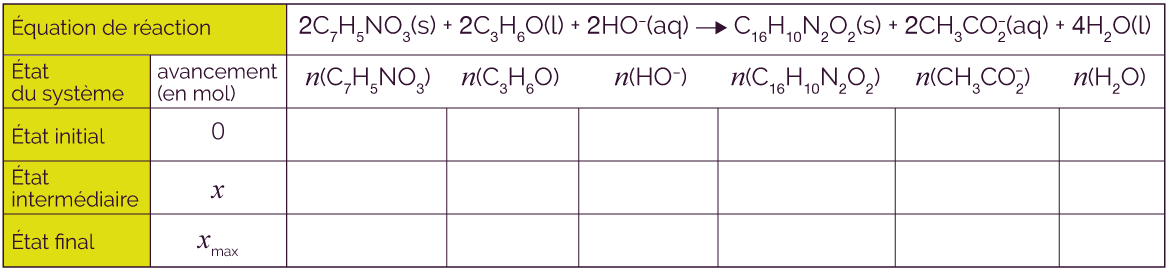
Tableau d’avancement de la réaction
On liste les grandeurs relatives aux réactifs utilisés.
- m(C7H5NO3) = 50 g
- V(C3H6O) = 5,0 mL
-
V = 4,0 mL
d’une solution d’hydroxyde de sodium
(Na+(aq) + HO−(aq)) à la concentration CB = 5,0 mol·L−1
On les convertit dans la bonne unité.
- V(C3H6O) = 5,0 mL = 5,0 × 10−3 L
- V(HO−) = 4,0 mL = 4,0 × 10−3 L
On calcule les quantités de matière initiales des réactifs à l’aide de l’énoncé.
-
n0(C7H5NO3) =
 avec :
avec :
M(C7H5NO3) = 7 × M(C) + 5 × M(H) + 1 × M(N) + 3 × M(O)
M(C7H5NO3) = 7 × 12,0 + 5 × 1,0 + 1 × 14,0 + 3 × 16,0
M(C7H5NO3) = 151 g·mol−1
Ainsi n0(C7H5NO3) =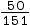 = 3,3 × 10−1 mol
= 3,3 × 10−1 mol
-
n0(C3H6O) =
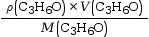 (car
(car 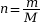 et
et 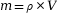 ), avec :
), avec :
M(C3H6O) = 3 × M(C) + 6 × M(H) + 1 × M(O)
M(C3H6O) = 3 × 12,0 + 6 × 1,0 + 1 × 16,0
M(C3H6O) = 58 g·mol−1
Ainsi n0(C3H6O) =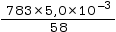 = 6,8 × 10−2 mol.
= 6,8 × 10−2 mol.
- n0(HO−) = CB × V(HO−) = 5,0 × 4,0 × 10−3 = 2,0 × 10−2 mol.
La quantité de matière des produits est
nulle puisqu’ils ne se sont pas encore
formés.
On a donc n0(C16H10N2O2) = 0 mol,
n0(CH3CO![]() ) = 0 mol
et n0(H2O) = 0 mol.
) = 0 mol
et n0(H2O) = 0 mol.
On remplit le tableau d’avancement en tenant compte des coefficients stœchiométriques devant chaque élément chimique.
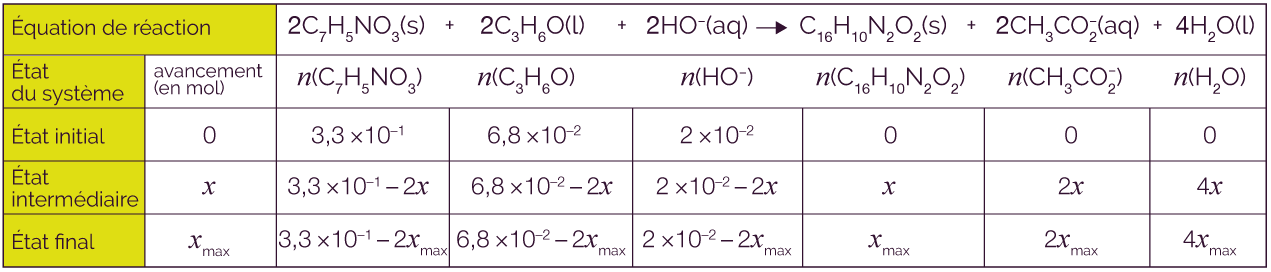
Pour déterminer l’avancement final xmax, on fait 3 hypothèses, car il y a 3 réactifs.
- Hypothèse 1 :
C7H5NO3 est le
réactif limitant,
donc 3,3 × 10−1 − 2xmax = 0, soit xmax = 1,7 × 10−3 mol. - Hypothèse 2 :
C3H6O est le réactif
limitant,
donc 6,8 × 10−2 − 2xmax = 0, soit xmax = 3,4 × 10−2 mol. - Hypothèse 3 : HO−
est le réactif limitant,
donc 2,0 × 10−2 − 2xmax = 0, soit xmax = 1,0 × 10−2 mol.
On en déduit l’avancement maximal xmax = 1,0 × 10−2 mol car c’est la plus petite valeur.
Le réactif limitant est donc l’ion hydroxyde HO−.
On peut ainsi en déduire la masse théorique de colorant indigo C16H10N2O2 obtenu grâce à la dernière ligne du tableau.
m(C16H10N2O2) = n(C16H10N2O2) × M(C16H10N2O2)
Or, n(C16H10N2O2) = xmax = 1,0 × 10−2 mol.
Application numérique :
m(C16H10N2O2)théo = 1,0
× 10−2 × 151
m(C16H10N2O2)théo =
1,51 g
On peut maintenant calculer le rendement de cette synthèse.
On applique la formule ![]() , avec :
, avec :
- m(C16H10N2O2)exp = 1,32 g ;
- m(C16H10N2O2)théo = 1,51 g.
η = ![]() = 0,87, soit
un rendement de 87 %.
= 0,87, soit
un rendement de 87 %.
La valeur de ce rendement est correcte mais pas parfaite, car on peut supposer que la réaction n’a pas été totale ou qu’il y a eu des pertes de produits tout au long des étapes de cette expérience.

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








