Réaliser une distillation fractionnée
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
Mettre en œuvre un dispositif de distillation fractionnée.
- La distillation fractionnée consiste à porter à ébullition un mélange de deux espèces chimiques liquides et non miscibles, afin de les séparer.
- Les deux espèces doivent avoir des températures d’ébullition différentes.
- Règles de sécurité au laboratoire
- Réaction chimique
- Verrerie
Au cours d’une réaction chimique, on souhaite synthétiser une espèce chimique la plus pure possible. La substance produite n’est cependant en général pas seule en solution, car il y a notamment le solvant.
Un chimiste doit être en mesure d’extraire
l’espèce chimique qu’il souhaite
d’un milieu réactionnel.
Il existe déjà la technique de la
décantation qui consiste à effectuer une
extraction liquide-liquide à l’aide
d’une ampoule à décanter. La
distillation fractionnée est une seconde technique
d’extraction liquide-liquide.
On considère un milieu réactionnel qui comporte plusieurs espèces liquides qui sont toutes miscibles et qui possèdent des températures d’ébullition différentes (les valeurs ne doivent pas être proches).
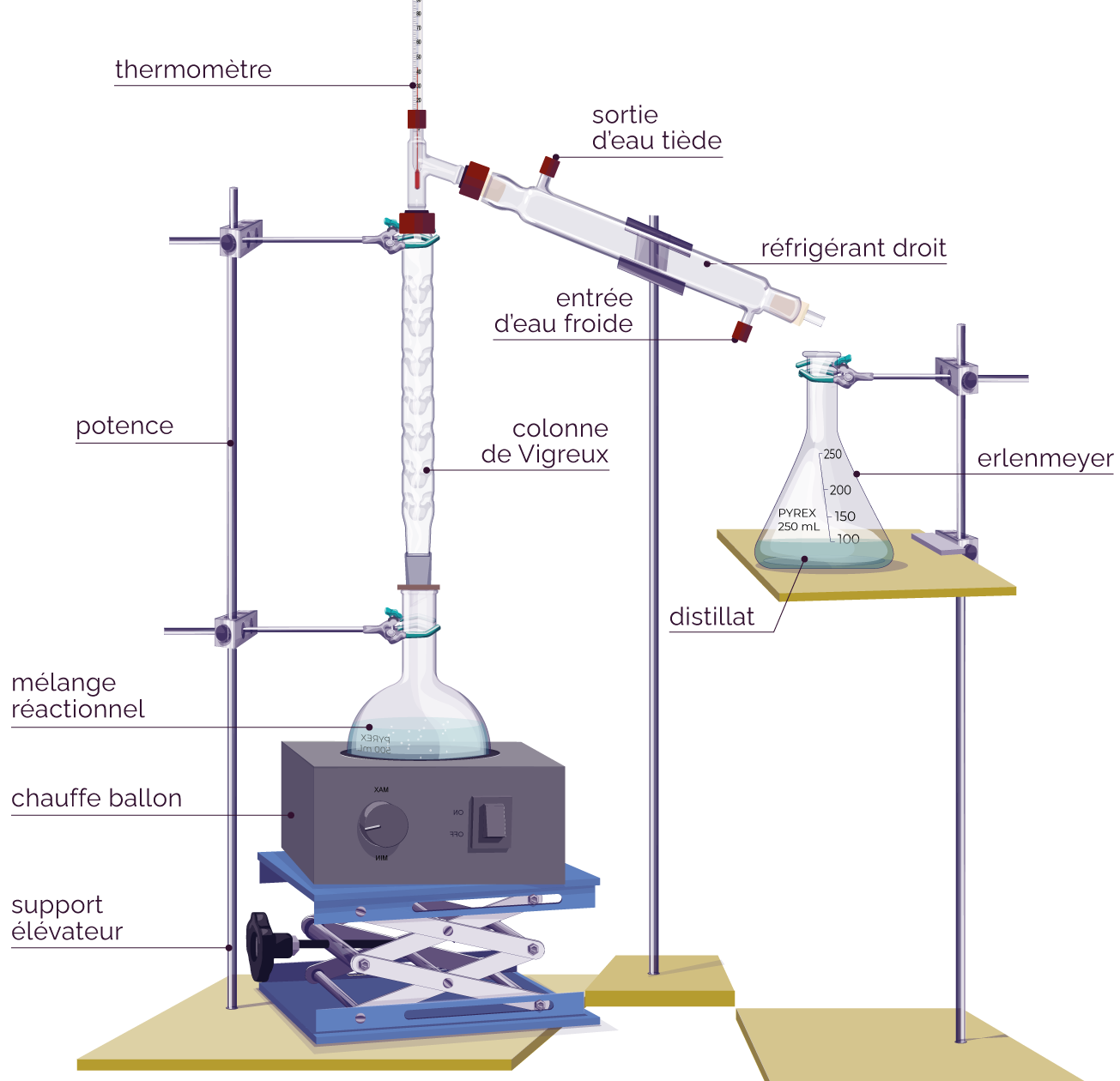
Montage de la distillation fractionnée
On chauffe le mélange à l’aide du chauffe-ballon. Lorsque la valeur affichée par le thermomètre se stabilise, l’espèce chimique qui possède la température d’ébullition la plus faible commence à s’évaporer.
Les vapeurs vont passer à travers la colonne de Vigreux et ensuite se condenser sur les parois froides du réfrigérant à eau. L’espèce chimique retombe enfin sous forme liquide dans l’erlenmeyer. Le liquide récupéré est celui qui est le plus volatil : il s’appelle le distillat et il est purifié grâce à cette technique.
Cette technique permet également de purifier le liquide que l’on récupère.
Dès que la température affichée par le thermomètre augmente, il faut arrêter la distillation car les vapeurs ne sont plus constituées de l’élément chimique à récupérer.
La distillation fractionnée permet de réaliser une réaction chimique accélérée à température constante, grâce aux différentes parties du montage.
- Le chauffage doux permet d’accélérer la transformation chimique.
- La colonne de Vigreux permet la condensation des vapeurs formées grâce aux pics orientés vers le bas. Elle permet ainsi une meilleure séparation des composants de température d’ébullition différentes. On l’utilise à la place d’un réfrigérant à eau classique lorsque le mélange contient des espèces de température d’ébullition proches.
- La circulation d’eau froide dans le réfrigérant à eau permet aux vapeurs formées de se liquéfier au contact des parois froides : il n’y a pas de vapeurs nocives qui s’échappent du montage et il n’y a pas de pertes du mélange réactionnel par évaporation.
- La pierre ponce permet de réguler l’ébullition en créant des petites bulles dans le mélange.
- Le thermomètre permet de contrôler la température du mélange pour être sûr d’extraire la bonne espèce chimique.
La distillation fractionnée nécessite l’utilisation du matériel de chimie suivant.
|
|
- Le support élévateur sert à stopper rapidement le chauffage dans le cas où la réaction s’emballe.
- La pierre ponce sert à homogénéiser la température du mélange réactionnel.
En Travaux Pratiques, la distillation fractionnée se fait suivant le protocole suivant.
-
Prélever les réactifs.
On prépare les réactifs du mélange réactionnel.- S’il s’agit d’une solution : on prélève le volume de réactif souhaité avec une pipette jaugée munie d’un pipeteur, afin d’avoir un maximum de précision.
- S’il s’agit d’un solide : on pèse la masse de réactif souhaitée à l’aide d’une balance.
-
Positionner le ballon.
On positionne le chauffe-ballon sur le support élévateur, puis le ballon sur le chauffe-ballon. On fixe le ballon à la potence, à l’aide d’une noix. -
Introduire les réactifs dans le
ballon.
On introduit la pierre ponce et le mélange réactionnel dans le ballon. -
Positionner la colonne de Vigreux.
On positionne la colonne de Vigreux sur le ballon et on ferme hermétiquement. On fixe la colonne à la potence à l’aide d’une noix et on positionne le thermomètre sur le dessus de la colonne de Vigreux. -
Positionner le réfrigérant à
eau.
On fixe le réfrigérant à eau à la colonne de Vigreux et à la potence à l’aide d’une noix. -
Brancher les tuyaux.
On fixe les 2 tuyaux au réfrigérant de façon à respecter un ordre précis.
- Le tuyau relié au bas du réfrigérant doit être fixé au robinet.
- Le tuyau relié au haut du réfrigérant doit être positionné dans le lavabo pour évacuer l’eau (une fois qu’elle a traversé le réfrigérant).
-
Positionner l'erlenmeyer.
On installe une deuxième potence et on y fixe l'erlenmeyer à l'aide d'une noix, afin qu'il se trouve sous le réfrigérant à eau. -
Allumer le chauffe-ballon.
On démarre le chauffage à reflux en branchant le chauffe-ballon et en l’allumant.
Pour réaliser un chauffage à reflux, il faut tenir compte des pictogrammes de danger qui sont associés aux réactifs et respecter les règles de sécurité suivantes.
- Porter des gants et des lunettes si les réactifs utilisés nécessitent une protection.
- Éviter toute flamme ou étincelle dans le cas où les espèces chimiques sont inflammables.

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








