Identifier des groupes caractéristiques par spectroscopie infrarouge
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
Identifier des groupes caractéristiques par spectroscopie infrarouge (IR).
- La spectroscopie IR permet d’identifier des molécules, de tester la présence de molécules dans un échantillon, ou peut servir dans le cadre d’un dosage.
- Le spectre IR d’un échantillon indique la transmittance en fonction du nombre d’onde : la transmittance correspond à la proportion de rayonnement qui traverse cet échantillon sans être absorbé, et le nombre d’onde est lié à la fréquence de résonance d’une liaison chimique.
- La fréquence d’un rayonnement dépend du type de liaison (simple ou multiple), de la masse des atomes concernés (légers ou lourds) et de l’emplacement de la liaison dans la molécule (liaison impliquée dans tel ou tel groupe caractéristique).
- Les groupes caractéristiques
- La liaison chimique
- La formule développée
Une liaison chimique entre deux atomes peut être vue comme un ressort, où les atomes sont assimilés à des masses accrochées à ses extrémités.
Ce système présente une fréquence d’oscillation qui lui est propre, dite fréquence de résonance. La liaison peut ainsi vibrer lorsqu’elle est frappée par une radiation électromagnétique, dont la fréquence correspond à sa fréquence de résonance, et absorber ainsi la radiation.
Chaque type de liaison (C — C, C — H, C — O, etc.) possède une fréquence de résonance qui lui est spécifique.
Les liaisons ont plusieurs manières de vibrer. On recense deux modes de vibration principaux : l’allongement et la déformation.
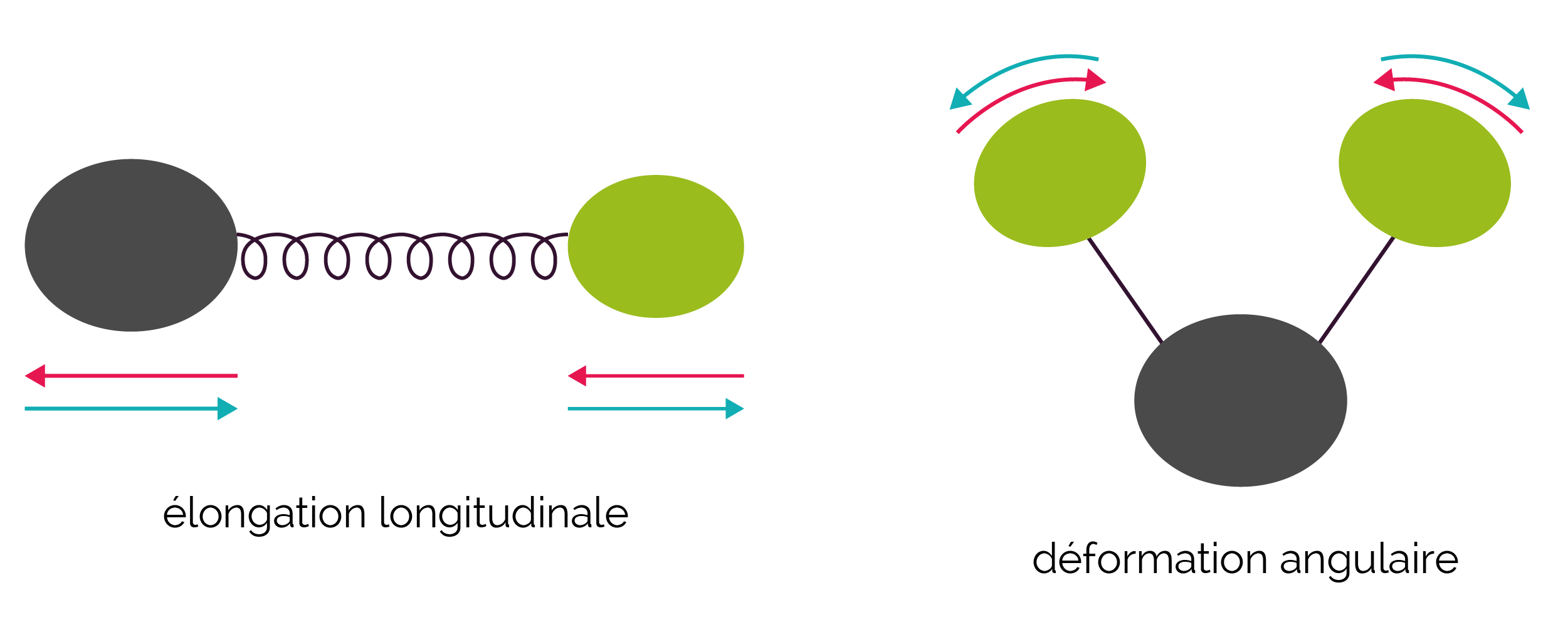
Vibration des liaisons moléculaires
Pour les liaisons chimiques, ces fréquences se situent dans l’infrarouge (IR).
Le principe d’une spectroscopie IR est donc d’envoyer des radiations IR sur un échantillon à tester.
Certaines longueurs d’onde sont alors absorbées par les liaisons chimiques des molécules qui se trouvent dans l’échantillon.
On génère alors un spectre IR. Les bandes d’absorption présentes permettent de déterminer quelles sont ces liaisons chimiques.
Une spectroscopie infrarouge peut avoir différentes finalités :
- tester la présence ou l’absence d’une molécule dans un échantillon ;
- identifier les groupes caractéristiques dans une molécule.
Un spectre IR met en jeu deux grandeurs : la transmittance T et le nombre d’onde σ.
Pour chaque longueur d’onde,
l’intensité I transmise par
l’échantillon est comparée à
l’intensité incidente I0, afin d’en
déduire la transmittance ![]() .
.
On l’exprime en pourcent.
Pour établir le spectre, au lieu de la longueur d’onde λ, il est courant de manipuler le nombre d’onde σ.
L’axe des abscisses, associé à σ, est orienté de droite à gauche.
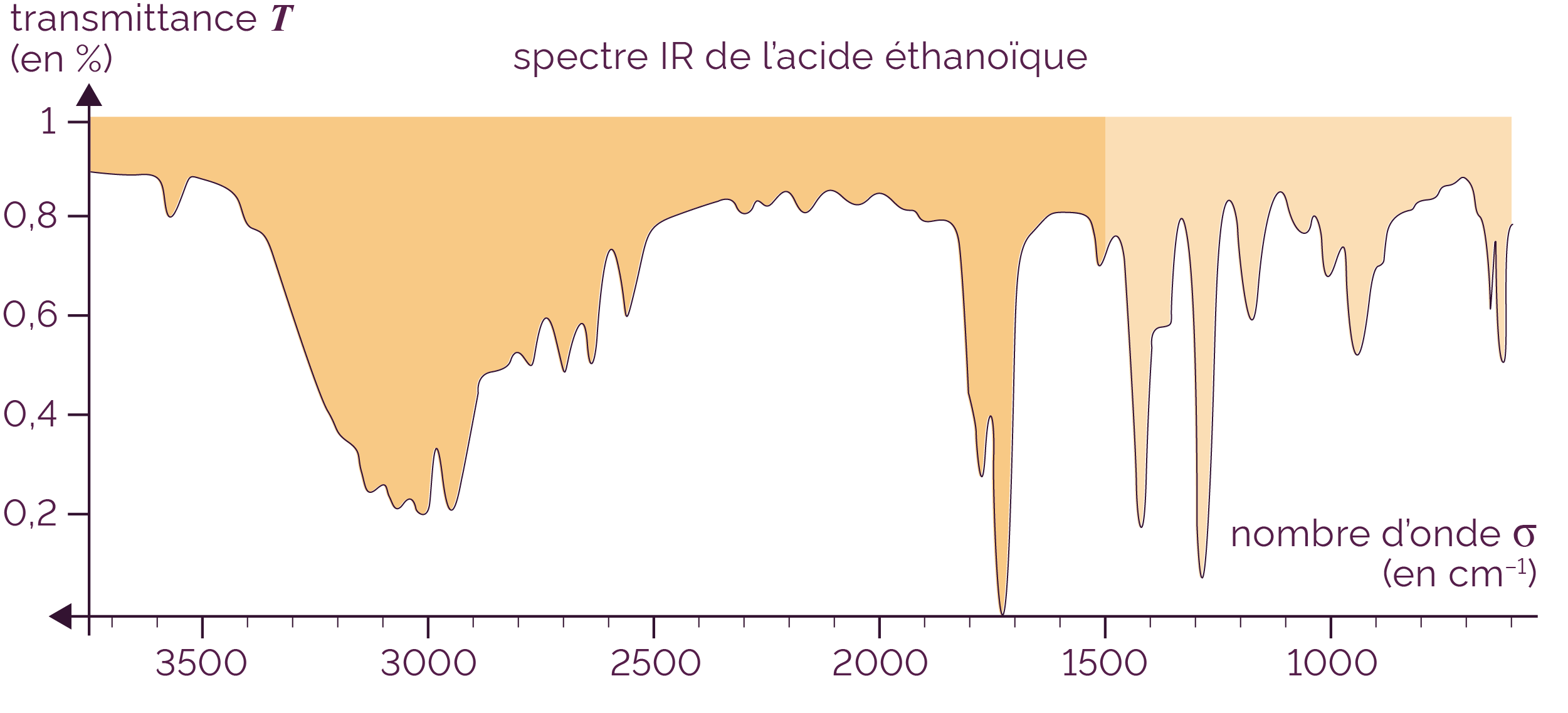
Spectre IR de l’acide éthanoïque
Les fortes baisses localisées de la transmittance, pour certains nombres d’onde, correspondent à l’absorption des liaisons chimiques. Ces baisses sont nommées bandes d’absorption.
Le groupe caractéristique permet de classer les molécules en familles : les alcools, les aldéhydes, les cétones et les acides carboxyliques.
Lors d’une spectroscopie IR, une liaison chimique impliquée dans un groupe caractéristique présente une bande d’absorption pour un nombre d’onde déterminé.
Cette bande d’absorption correspond à une baisse de la transmittance. Elle se manifeste par un pic vers le bas dans le spectre IR de la molécule.
Le tableau ci-dessous est une table de la spectroscopie IR : il répertorie quelques groupes caractéristiques en précisant le nombre d’onde d’absorption pour les liaisons concernées.
| Groupe caractéristique | Famille associée (ou fonction) | Formule semi-développée du groupe caractéristique | Nombre d’onde d’absorption des liaisons chimiques associées |
| Hydroxyle | Alcool |
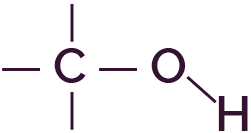
|
σO–H = 3200 – 3450 cm−1 |
| Carbonyle | Aldéhyde |
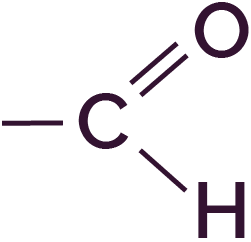
|
σC=O = 1700 – 1740 cm−1 σC–H = 2650 – 2900 cm−1 σH–C=O = 2700 – 2850 cm−1 |
| Carbonyle | Cétone |
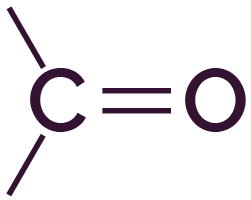
|
σC=O = 1700 – 1725 cm−1 σC–H = 2650 – 2900 cm−1 |
| Carboxyle | Acide carboxylique |
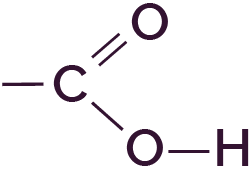
|
σC=O = 1740 – 1800 cm−1 σO–H = 2500 – 3300 cm−1 |
Ces valeurs de référence ne sont pas à connaitre, elles sont fournies par l’énoncé.
On dispose d’un spectre d’absorption IR d’une molécule et on cherche à identifier ses groupes caractéristiques.
Il faut s’appuyer sur les tables de la spectroscopie infrarouge, qui contiennent les nombres d’onde associés aux groupes caractéristiques des différents molécules (voir partie 3.).
On peut ainsi exploiter un spectre à l’aide de ces tables, en suivant la méthode suivante.
Sur le spectre, on identifie la valeur du nombre d’onde associé à chacune des bandes d’absorption, pour des nombres d’onde supérieurs à 1500 cm−1.
Les nombres d’ondes situés avant 1500 cm−1 correspondent à une zone très riche en bandes d’absorptions. Cet interval constitue ainsi l’empreinte digitale de la molécule et n’est pas exploitable pour l’identification de groupes caractéristiques dans une molécule.
On associe chaque nombre d’onde trouvé à la liaison qui correspond dans les tables.
On conclut quant à la présence d’un groupe caractéristique présent dans cette molécule.
On souhaite exploiter ce spectre d’absorption IR pour identifier les groupes caractéristiques présents dans cette molécule.
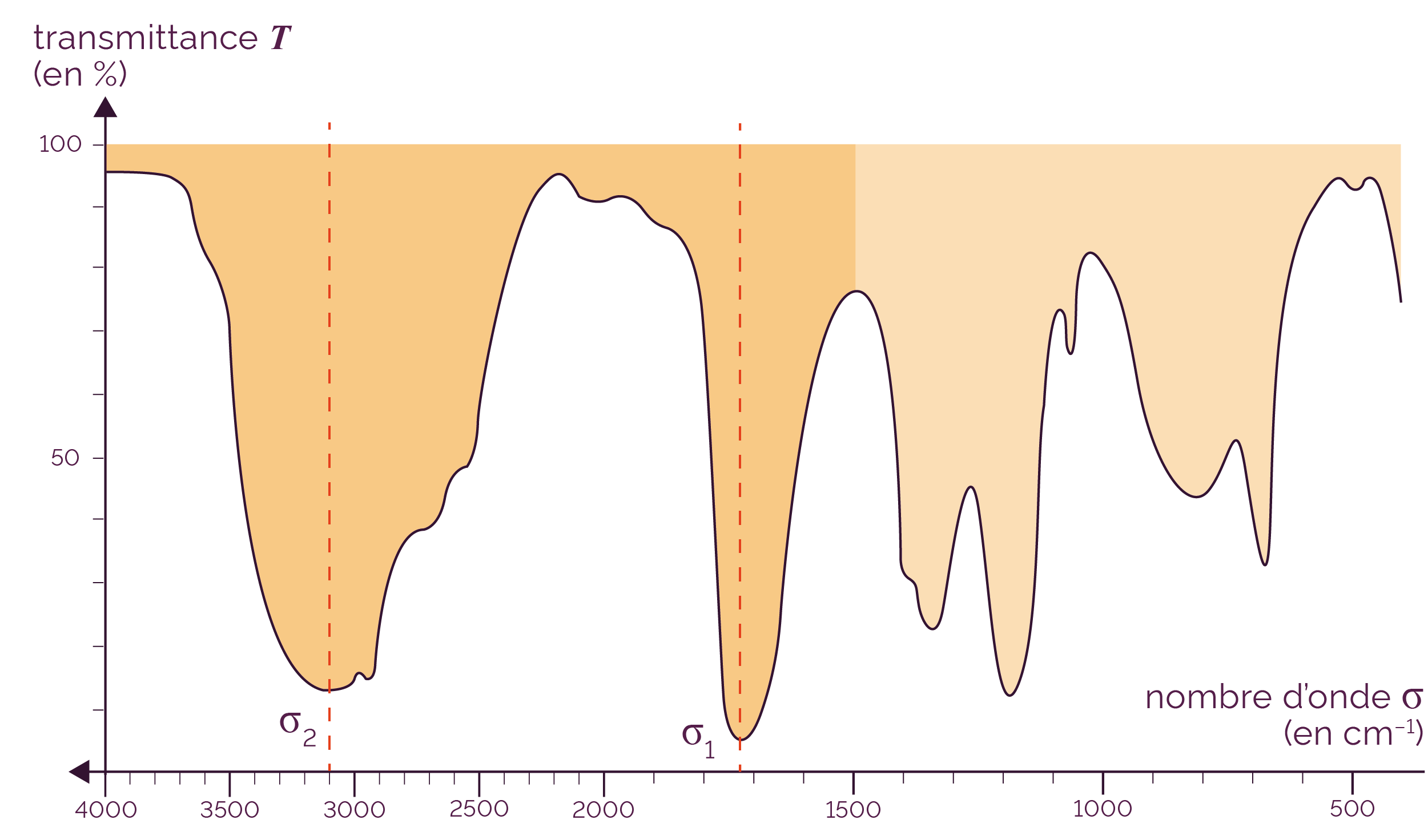
Spectre IR
Donnée : Table pour la spectroscopie IR (voir partie 3.)
- On identifie 3 bandes d’absorption sur ce spectre d’absorption qui sont supérieures à 1500 cm−1. Chaque bande d’absorption est associée la valeur de nombre d’onde suivante : σ1 = 1740 cm−1 et σ2 = 3100 cm−1.
- D’après les tables :
- σ1 correspond à la liaison C = O de l’acide carboxylique ;
- σ2 correspond à la liaison O — H de l’acide carboxylique.
- On peut donc conclure que cette molécule appartient à la famille des acides carboxyliques.

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








