Réaliser un protocole d'extraction liquide-liquide
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
- Interpréter un protocole d’extraction liquide-liquide à partir des valeurs des solubilités de l’espèce chimique dans les deux solvants.
- Choisir un solvant et mettre en œuvre un protocole d’extraction liquide-liquide d’un soluté moléculaire.
- Un solvant peut être utilisé dans une
extraction liquide-liquide s’il est :
- non miscible avec le solvant qui contient l’espèce chimique à extraire ;
- et si la solubilité de l’espèce chimique est plus grande dans ce solvant d’extraction que dans le solvant de départ.
- Deux liquides non miscibles forment un mélange hétérogène où la phase supérieure est occupée par le liquide le moins dense.
- Un protocole d’extraction liquide-liquide se fait en quatre étapes et on utilise une ampoule à décanter.
- La solubilité d’une espèce chimique
- La densité d’un liquide
- La miscibilité
- l’espèce chimique à extraire est plus soluble dans le solvant d’extraction que dans le solvant de départ ;
- le solvant d’extraction n’est pas miscible au solvant de départ ;
- le solvant doit être celui qui présente le moins de risques possibles.
Si une espèce chimique est plus soluble dans un solvant S1 que dans un solvant S2, cela signifie que sa solubilité est plus grande dans le solvant S1 que sa solubilité dans le solvant S2.
La solubilité est égale à la concentration (en quantité de matière ou massique) maximale de l’espèce chimique dans le solvant.
Le diiode de formule I2 possède les solubilités s suivantes dans le cyclohexane (qui est un solvant organique) et dans l’eau :
scyclohexane(I2) = 28,0 g·L−1 et seau(I2) = 0,3 g·L−1.
On constate que scyclohexane(I2) > seau(I2).
Le diiode est donc plus soluble dans le cyclohexane que dans l’eau.
Un solvant est un liquide dans lequel sont dissoutes diverses espèces chimiques (solides, liquides ou gazeuses).
L’eau et l’huile sont deux liquides non miscibles tandis que l’eau et le vinaigre sont deux liquides miscibles.
La densité d’un liquide par rapport à l’eau est une grandeur sans unité, égale au rapport de la masse volumique du liquide sur celle de l’eau.
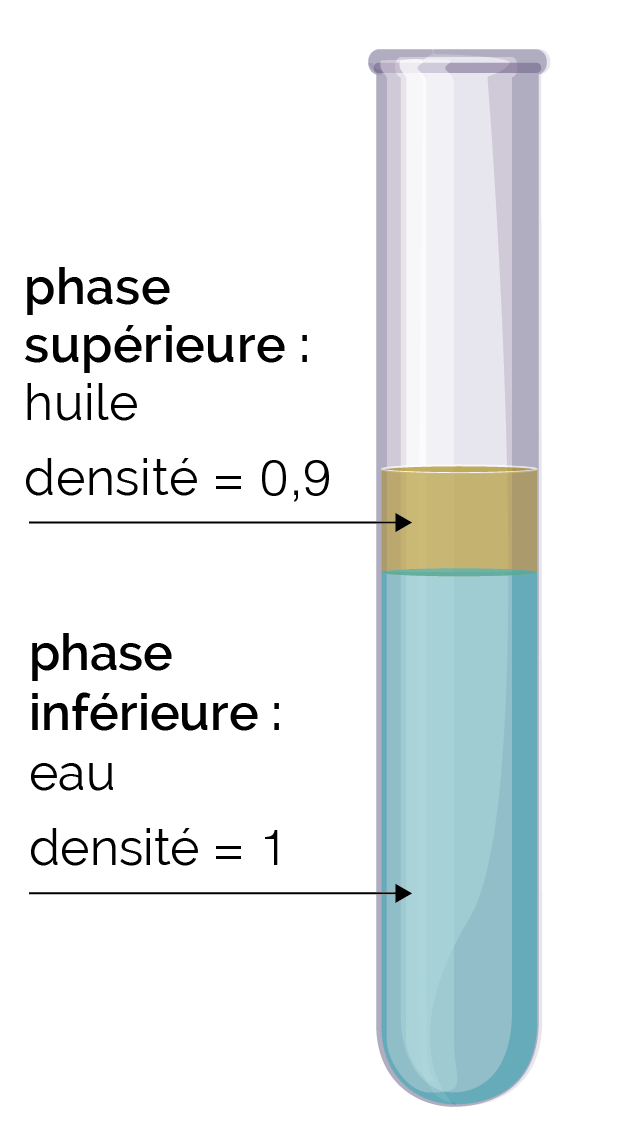
- La densité de l’eau est égale à 1.
- Si la densité du liquide est supérieure à 1, alors il est plus « lourd » que l’eau.
- Si la densité du liquide est plus petite que 1, alors il est plus « léger » que l’eau.
Dans le mélange eau-huile, la phase supérieure est occupée par l’huile (de densité environ égale à 0,9) et la phase inférieure est occupée par l’eau (de densité égale à 1).
Pour séparer des liquides non miscibles, on utilise généralement un récipient que l’on appelle une ampoule à décanter.

Exemple d’ampoule à décanter
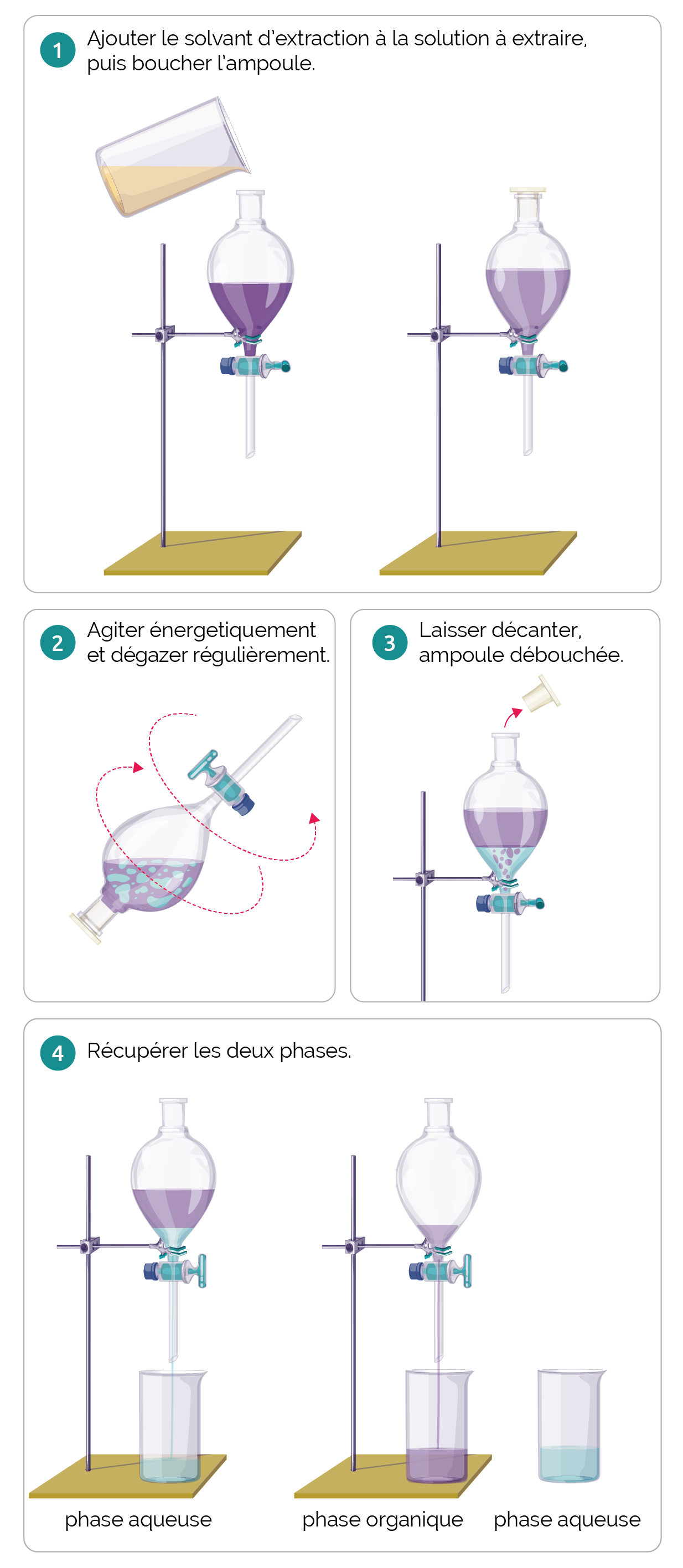
L’extraction liquide-liquide d’une espèce chimique s’effectue en quatre étapes.
- Ajouter le solvant d’extraction à la
solution à extraire.
- Placer l’ampoule à décanter sur un support pour qu’elle reste verticale.
- Vérifier que le robinet de l’ampoule est fermé.
- Verser le mélange dans l’ampoule à décanter.
- Boucher l’ampoule à décanter.
- Agiter énergiquement l’ampoule à décanter et dégazer régulièrement.
- Laisser reposer le mélange (décantation), ampoule débouchée, jusqu’à ce que l’un des liquides surnage entièrement.
- Récupérer les deux phases.
- Placer un récipient sous le robinet de l’ampoule à décanter afin de récupérer le premier liquide.
- Lorsque la surface de séparation des liquides est proche du robinet, ralentir le débit de ce dernier (goutte à goutte) jusqu’à l’écoulement total du premier liquide.
- Placer un autre récipient pour récupérer le second liquide.
Le visuel ci-dessous récapitule ces quatre grandes étapes.
À la fin de l’étape 3, après la décantation, le mélange dans l’ampoule à décanter est hétérogène. On trouve une phase composée du solvant de départ et une phase composée du solvant d’extraction, dans lequel est dissoute l’espèce chimique à extraire.
Le solvant dont la densité est la plus faible occupe la phase supérieure.
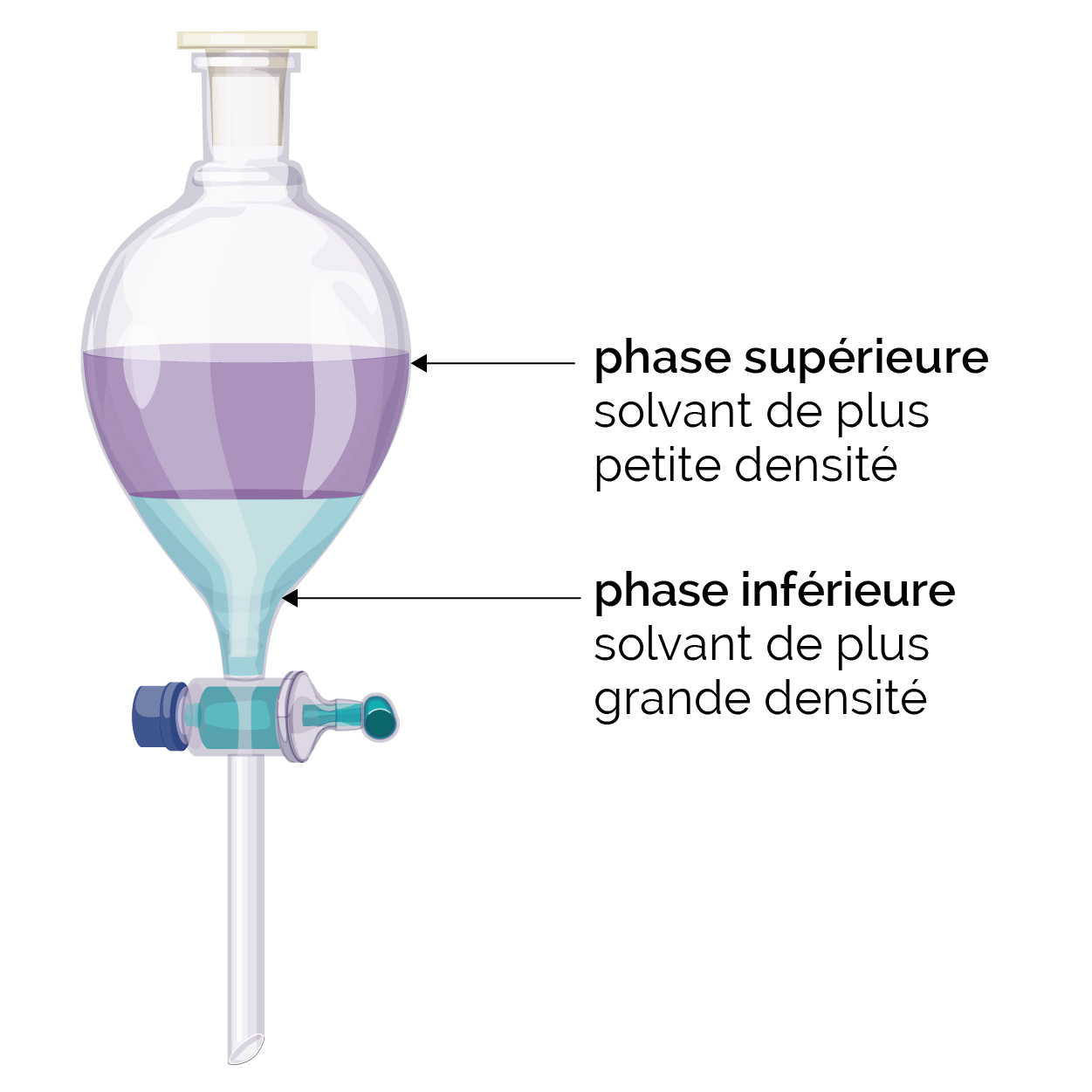
Contenu de l’ampoule à décanter à l’issue de la décantation

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








