Production de dihydrogène
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
Il est donc considéré comme un carburant d’avenir.
Cependant, le dihydrogène n’est quasiment pas présent sur Terre à l’état naturel, à la différence de l'élément hydrogène qui est omniprésent.
Mais comment le dihydrogène est-il produit dans l’industrie ?
Étape 1
Par exemple, 1 molécule de méthane (
Étape 2
Le monoxyde de carbone ainsi formé réagit à son tour avec l'eau (pour former du dioxyde de carbone et du dihydrogène) selon l'équation suivante:
Cette étape est possible à des températures plus basses (environ 130 °C).
Le monoxyde de carbone
Globalement, la réaction de vaporeformage s’écrit :
Ce procédé de fabrication de dihydrogène nécessite :
•un apport d’énergie sous forme de chaleur (brûleur) afin que les conditions requises soient réunies.
•un catalyseur, accélérant la réaction.
Les hydrocarbures sont les réactifs de cette réaction. Des ressources fossiles (telles que le pétrole, le méthane) sont ainsi mises à contribution, ce qui pose le même problème que pour les carburants classiques : les ressources fossiles ne sont pas inépuisables.
Toutefois, il est également possible de faire appel à la biomasse pour les remplacer.
On peut noter un inconvénient majeur de cette réaction: la libération de gaz à effet de serre (CO2). La combustion du dihydrogène n’en produit pas. En revanche, sa fabrication industrielle, oui.
Pourquoi ne pas utiliser l’énergie électrique pour « casser » des molécules d’eau, afin de générer de l'O2 et du H2 ?
Exemple d’une électrolyse à pH neutre :
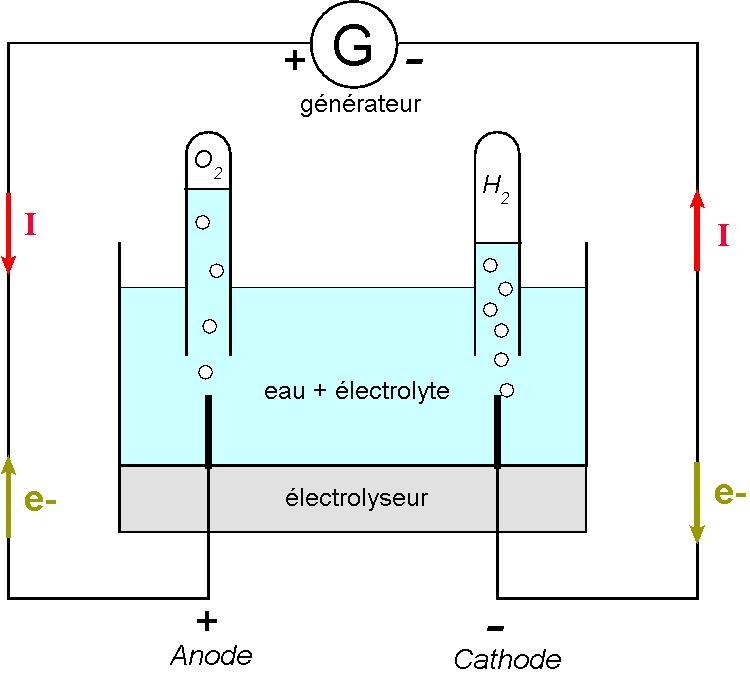
Au niveau de la cathode, se produit la réaction de réduction suivante:
Au niveau de l’anode, se produit la réaction d’oxydation suivante:
Les ions hydroxydes (
En conséquence, la réaction de l’électrolyse est :
L’électrolyse de l’eau est une méthode simple à mettre en œuvre pour produire du dihydrogène. Elle peut se faire à petite échelle (manipulation de TP) ou à plus grande échelle (usines chimiques),
Cette méthode est :
• non-polluante
• gourmande en énergie électrique
• problématique en ce qui concerne l'utilisation de l'eau: avant c'était une ressource, désormais, c'est une richesse
• Par réaction avec des métaux
Historiquement, cette méthode a été très employée au XIXème et au début du XXème siècle. On sait que certains métaux (tels que le fer ou l'aluminium), attaqués par un acide, produisent un dégagement de dihydrogène. L’attaque de l’aluminium par une base (la soude, NaOH) se présente sous forme d'équation:
Intérêt : la soude est régénérée par la réaction :
• L’oxydation partielle d’hydrocarbures
Le principe est proche de celui de l'étape 1 du vaporeformage, à la différence que l’on remplace
Avantage : libération d'énergie, donc pas besoin de chauffer. Par contre, comme pour le vaporeformage, il y a production de monoxyde de carbone, qui est alors transformé en dioxyde de carbone lors de l'étape 2.
• Utilisation d’algues
Des algues peuvent, dans certaines conditions, produire du dihydrogène. L’énergie lumineuse du Soleil est ainsi exploitée dans ce cas-là.
• Électrolyses à hautes températures
Nécessitant moins d’électricité que les électrolyses classiques, ce type d'électrolyses peuvent utiliser trois sources de chaleur afin d'atteindre les températures requises (jusqu’à 900 °C dans la pratique) : solaire, géothermie, ou de futurs réacteurs nucléaires hautes températures.
Toutefois, le transport du dihydrogène présente des contraintes importantes. On peut le liquéfier comme le méthane, afin qu’il prenne moins de place (méthaniers). Cependant, le méthane se liquéfie à
Le dihydrogène est souvent transporté et conservé sous forme gazeuse, sous de hautes pressions (350 ou même 700 bars). Mais, du fait de sa petite taille, il a tendance à s’échapper des récipients qui le contiennent. Il peut également fragiliser les aciers. D’autre part, comme c’est un gaz très léger, il monte rapidement dans l’atmosphère terrestre une fois libéré. D’ailleurs, dans certains cas, il est courant que le dihydrogène soit produit directement sur le lieu de consommation.
Des projets de recherche tentent de fixer temporairement le gaz dans des matériaux solides, plus précisément en l’incorporant dans la structure moléculaire du solide (hydrures métalliques …).
→ Le vaporeformage, produisant le gaz à partir d’hydrocarbures :
• Méthode la plus employée, mais qui a le défaut de libérer également du dioxyde de carbone.
→ L’électrolyse de l’eau, générant de l'énergie électrique pour produire le gaz:
• Méthode non polluante, mais présentant le défaut de consommer énormément d’énergie électrique.
La combustion de ce gaz dans le dioxygène ne génère que de l’eau.
C’est un vecteur énergétique car il constitue une forme d’énergie pouvant être transportée (comme l’électricité). Le dihydrogène peut de plus être conservé. En revanche, le transport et la conservation du gaz sont contraignants.

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








