Piles à combustible
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
Préciser le fonctionnement de ces appareils.
Présenter leurs avantages/ inconvénients.
Indiquer les pistes de recherche actuelles afin de développer et perfectionner la technologie des piles à combustibles.
Comme une pile électrique classique, elle produit du courant électrique continu. Cependant, la pile à combustible n'utilise pas des couples rédox métalliques, mais un combustible, et un comburant (le dioxygène). Intérêt: le combustible est plus abondant et est moins polluant que les couples rédox utilisés dans une pile.
D’un point de vue chimique, la réaction globale ayant lieu au sein de la pile à combustible s’écrit souvent comme celle d’une combustion.
Historiquement, la première pile à combustible datant de 1839 a été inventée par William Robert Grove. Dès 1932, ses travaux furent repris par Francis Thomas Bacon, qui mit au point les premiers prototypes de piles à dihydrogène capables de produire une énergie électrique. Les premières utilisations concrètes concernent les missions spatiales dont Apollo, Gemini, et les navettes spatiales. Plus récemment, les piles à combustible ont connu un regain d’intérêt et ont été perfectionnées.
Les piles à combustible sont constituées d’un assemblage de cellules électrochimiques, d’où l’appellation « pile ». La tension aux bornes d’une cellule est souvent de l’ordre de 0,7 V. L’association d’un certain nombre de cellules permet d’obtenir des tensions et courants électriques adaptés aux besoins. Certains types de piles sont capables de délivrer des puissances électriques conséquentes, de l’ordre du mégaWatt (
Le combustible et le comburant sont apportés aux cellules en continu, mais ces dernières ne stockent pas les réactifs. Pour exprimer le débit d’alimentation en gaz d’une pile à combustible, on peut raisonner en
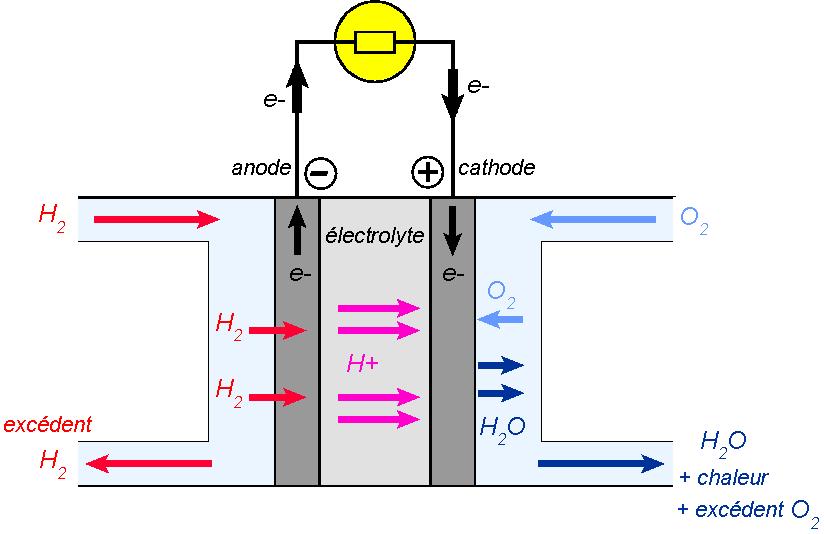
Dans cette pile, le dihydrogène arrive au niveau de l’anode, et est ionisé selon la réaction d’oxydation:
Les électrons sont captés par l’électrode et injectés dans le circuit électrique.
L’anode constitue la borne négative.
Les protons, quant à eux, passent à travers la membrane constituée par l’anode. Ils vont migrer à travers l’électrolyte jusqu’à atteindre la cathode.
Dans la pile décrite ici, l’électrolyte est constitué d’une membrane polymère hydratée. Avec les électrons incidents à la cathode et l'arrivée de dioxygène, les protons participent à la réaction de réduction:
La cathode est la borne positive.
L'équation globale de la réaction est:
Elle est exothermique c'est-à-dire qu' il y a dégagement de chaleur au sein de la pile (pouvant dépasser exceptionnellement 100 °C!). La vapeur d’eau produite sort de la pile en emportant une part de l’énergie thermique. Cette chaleur peut être mise à profit : chauffage, source d’eau chaude.
Au niveau des deux électrodes, les demi-réactions sont catalysées (la platine est le plus fréquent des catalyseurs).
La technologie des piles à combustible à membrane d'échange de protons est actuellement en plein développement grâce aux progrès effectués en physique des matériaux (en ce qui concerne les membranes).
Les piles à combustible à acide phosphorique sont une variante de ce type de pile. Dans ce cas, de l’acide phosphorique est utilisée comme électrolyte. Ces piles fonctionnent aux alentours de 200 °C et assurent des puissances électriques allant jusqu’à 10 MW (ces piles sont utilisées dans les usines, hôpitaux...).
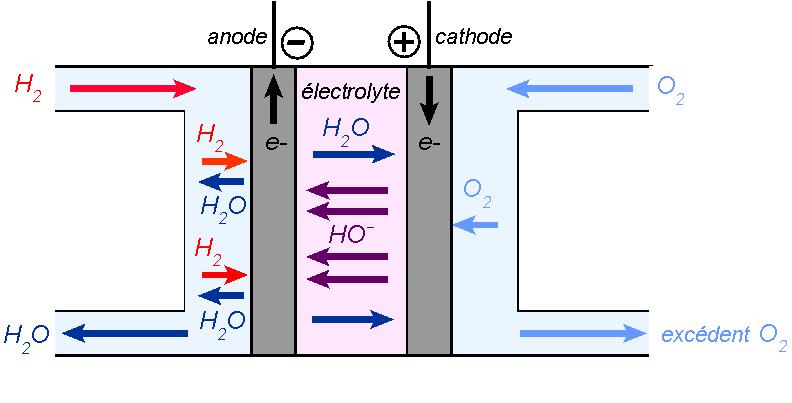
Au niveau de la cathode (borne positive), le dioxygène réagit avec de l’eau selon la réaction :
Il s’agit d’une réduction.
Puis, les ions
Une partie de l’eau produite va s’échapper de la pile sous la forme de vapeur d’eau. L’autre partie restera dans la solution alcaline de l’électrolyte, de sorte que la solution ne verra pas sa quantité d’eau varier. La réaction globale qui a lieu est ainsi :
La température de fonctionnement est entre 60 °C et 90 °C, pour des puissances allant de 10 à 100 kW. Les piles à combustible alcaline et les piles à membrane d’échange de protons sont toujours présentes dans le cadre d’applications spatiales. En effet, les coûts et contraintes dans ce domaine (pureté des gaz utilisés) sont compatibles avec ces deux types de pile.
• Le platine employé en tant que catalyseur est un polluant. Coûteux, certaines recherches visent à diminuer son utilisation ou le remplacer par de nouveaux matériaux (tels que des polymères ou des nanoparticules).
• Pour les piles à hydrogène « basses températures », les gaz combustibles et comburants doivent être très purs. Sinon un empoisonnement catalytique peut avoir lieu aux niveaux des électrodes (par le CO2 et le CO). En conséquence, l’arrivée de dioxygène est souvent constituée d’une arrivée d’
• Les piles à combustible sont chères : c'est pourquoi cette technologie ne s’est pas développée davantage.
• Le dihydrogène est un combustible non-polluant. Cependant, il est rare d'où l'obligation de le produire industriellement à partir d’un autre combustible (hydrocarbures ou autre) : on parle alors de reformage. Ainsi, il peut être imaginé de faire appel directement à des combustibles « standards », sans faire appel au dihydrogène.
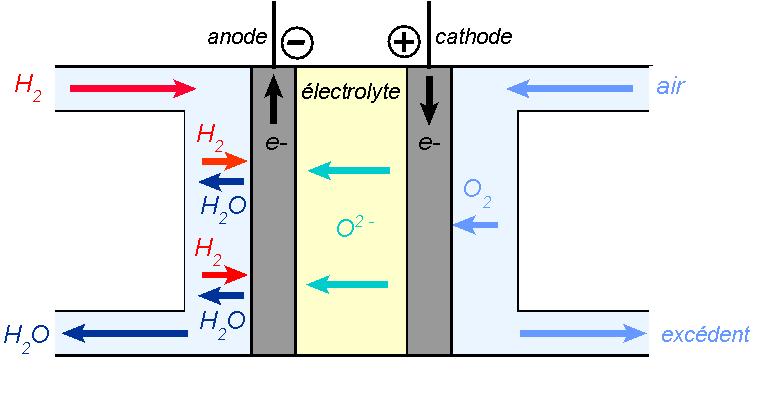
De l’air non purifié est ainsi utilisable au niveau de la cathode.
Ces piles présentent la particularité de pouvoir employer divers types de combustibles, et pas seulement le dihydrogène: le méthane, par exemple. Ces piles sont donc de bons candidats pour des installations fixes, où la production d’électricité se fait en continu. Ces piles sont en effet longues à démarrer. Cependant, des travaux de recherche visent à les adapter au secteur automobile.
Dans la gamme des piles hautes températures, on rencontre aussi les piles à combustible à carbonate fondu, dont le fonctionnement est plus complexe, mais qui présentent des caractéristiques assez proches de celles à oxyde solide.
Dans une pile à méthanol :
Réaction au niveau de l'anode :
Réaction au niveau de la cathode :
Réaction globale:
Le méthanol étant toxique pour l’Homme, on le remplace par de l'éthanol.
Les piles à combustibles à alcool fonctionnent à faibles puissances (plusieurs kW) et à basses températures (jusqu’à 120 °C). Leurs domaines d’applications concernent les technologies portables (téléphonie ou ordinateurs) car on peut les miniaturiser.
D’une manière générale, elle est alimentée en dioxygène à la cathode et en combustible à l’anode. Entre ces deux électrodes se trouve un électrolyte où migrent des ions, rendant possible les demi-équations électroniques au niveau de chaque électrode.
La réaction globale lorsqu’une pile à combustible fonctionne s’écrit souvent comme celle d’une combustion.
Il existe plusieurs types de piles à combustible divergeant par choix de l’électrolyte (et par extension des ions qui vont migrer), la température et la puissance électrique délivrée.
Des recherches visent à limiter ou à remplacer le platine et étudient la possibilité d’utiliser directement des combustibles (comme des hydrocarbures ou des alcools) sans avoir à les reformer en dihydrogène.

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








