Principe d'un étalonnage - Exploitation d'une courbe d'étalonnage
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
• soit un dosage par étalonnage ;
• soit un dosage par titrage.
Nous allons développer le dosage par étalonnage et faire les rappels mathématiques nécessaires à l’exploitation d’une courbe d’étalonnage.
Lors d’un dosage par étalonnage, on
cherche à déterminer la
concentration de
l’espèce x dans la
solution S (concentration molaire:
[x]S en
mol.L-1 ou concentration massique
t en g.L-1).
Préparation et mesures :
• on mesure une grandeur physique
MS liée à la
concentration [x]S dans la solution S. On
cherche en général une fonction
linéaire M = k.[x] ;
• on prépare une gamme de
solutions étalon de différentes
concentrations de l’espèce
X : concentrations connues, [x]2, etc
;
• on mesure la même grandeur
physique M pour toutes les solutions
étalon : M1,
M2, etc.
• on trace le graphique
correspondant : Mi =
f([x]i) ;
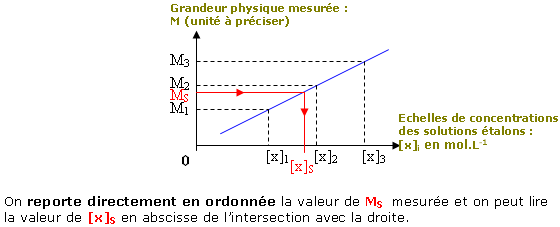
• on reporte la valeur
MS
correspondante à x en ordonnée et on
lit [x]S en abscisse ;
• ou alors, on détermine
l’équation de Mi =
f([x]i) pour calculer
[x]S en fonction de MS.
Pour une espèce
colorée :
La spectrophotométrie permet de mesurer
l'absorbance notée A, à la longueur
d'onde λ.
Pour les espèces ioniques
:
La conductimétrie permet de
déterminer la conductivité
![]() en fonction de la
concentration [Xn+]. Attention aux
unités, [Xn+] s'exprime en
mol.m-3 = 10-3
mol.L-1) :
en fonction de la
concentration [Xn+]. Attention aux
unités, [Xn+] s'exprime en
mol.m-3 = 10-3
mol.L-1) :
Si les ions présents en solution sont
Xn+ et Zm-, alors :
![]() .
.
Avec σ la conductivité en
S.m-1 ;
λi la conductivité molaire
ionique de l'ion Ai en
S.m2.mol-1 ;
et les concentrations des espèces ioniques
[Ai] en mol.m-3.
A l'aide des coefficients stoechiométriques de l'équation de dilution, on peut trouver une relation du type :
![]()
D’autres techniques peuvent être utilisées mais elles sont en général moins précises. Il s'agit de la colorimétrie (échelles de teintes avec vérification visuelle), de la précipitation (échelle de mélanges plus ou moins concentrés), de la pressiométrie, etc.
Le graphique est en général une droite puisqu’on choisit une grandeur physique qui est fonction linéaire de la concentration.
Règles de tracé
d’un graphique :
• Le tracé se fait au crayon à
papier ;
• Placer l’origine du repère, les
deux axes fléchés et y indiquer la
grandeur et son unité ;
• Placer les points en forme de croix ;
• Tracer la droite et donner un titre au graphe
ainsi obtenu.
On obtient :
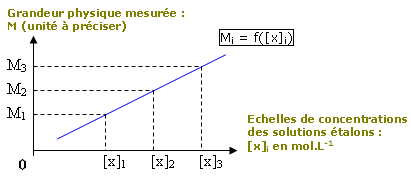
Méthode 1 :
Méthode
2 :
On détermine l'équation de la droite en
calculant son coefficient directeur k d'après
la relation ![]() :
:
![]()
Une fois k déterminé, on pourra déduire la valeur de [x]s par le calcul :
![]() .
.
• Pour effectuer un dosage par étalonnage, on prépare des étalons de concentrations en x connues et on mesure pour chaque échantillon une grandeur physique (absorbance, conductivité…) liée à sa concentration par une relation linéaire (si possible).
• Il reste donc à tracer la droite et à déterminer graphiquement ou par le calcul la concentration inconnue [x]S grâce à la valeur de la grandeur physique mesurée pour x.

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








