Titrages directs
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
• Détailler le montage à réaliser pour effectuer un titrage.
• Insister sur la notion d’équivalence et sur la relation à l’équivalence associée.
• Donner des exemples de calculs liés à cette manipulation.
L’idée générale d’un titrage est de consommer complètement le réactif à titrer en introduisant progressivement un réactif titrant. Dans un titrage direct, la manipulation ne met en jeu qu’une seule réaction chimique, contrairement à un titrage indirect qui en utilise plusieurs (pour consommer le titré, puis le titrant).
En Terminale S, nous verrons trois méthodes pour détecter quand on a consommé tout le réactif à titrer : par conductimétrie, par pH-métrie et par colorimétrie. Ces méthodes sont détaillées dans des fiches spécifiques.
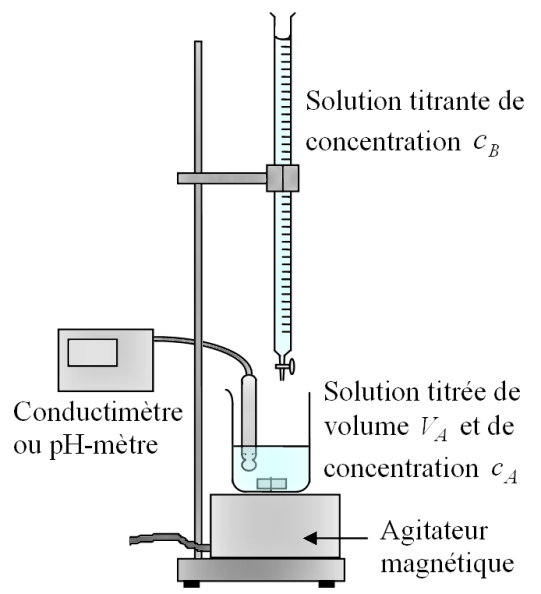
Nous noterons cA (en mol/L) la concentration du réactif titré A. C’est la grandeur que l’on cherche à estimer. VA(en L) est le volume de la solution titrée au début de la manipulation. En fait, rien n’interdit de verser modérément de l’eau distillée dans le bécher pendant la manipulation, par exemple pour faire tomber dans le milieu réactionnel une goutte de solution titrante qui serait restée sur la paroi du bécher. En effet, verser de l’eau distillée ne modifie pas la quantité de matière cA.VA du réactif titré.
On note cB (en mol/L) la concentration de réactif titrant B présent dans la burette. cB doit être connue avec précision. VB (en L) est le volume de réactif titrant versé dans le bécher.
Quelques conseils et précautions pour préparer le titrage dans de bonnes conditions :
• lors de la préparation de la burette, mettre un bécher « poubelle » sous cette dernière, en cas de coulée intempestive ;
• rincer la burette à l’eau distillée puis avec la solution titrante B ;
• remplir la burette jusqu'au zéro (attention au ménisque) ;
• le volume de solution à titrer doit être précis, donc prélever ce volume avec une pipette jaugée deux traits ;
• utiliser un agitateur magnétique afin que le milieu réactionnel dans le bécher soit homogène.
→ Rapide : la réaction doit être terminée quasi immédiatement, sinon le titrage serait trop long à effectuer. Il se poserait aussi le problème d’estimer le temps requis à attendre entre deux versages, pour être sûr que la réaction soit considérée comme terminée à chaque fois.
→ Totale ou considérée comme telle : la réaction doit se produire jusqu’à épuisement total d’un des deux réactifs, qui est ainsi le réactif limitant. On dit que la réaction est quantitative.
→ Unique : La réaction support du titrage doit être la seule à se dérouler dans le milieu réactionnel durant la manipulation, ou alors les autres réactions doivent être négligeables et/ou ne pas modifier les quantités de matière des réactifs.
Nous écrivons la réaction support du titrage ainsi :
On définit ainsi trois phases lors du titrage par rapport à l’équivalence :
→ Avant l’équivalence, le réactif A est en excès : le réactif titrant B est le réactif limitant.
→ À l’équivalence, le titrant B et le titré A sont tous deux réactifs limitants.
→ Après l’équivalence, le réactif titré A a totalement disparu : quand on rajoute le réactif titrant B, il ne réagit pas et s’accumule dans le bécher.
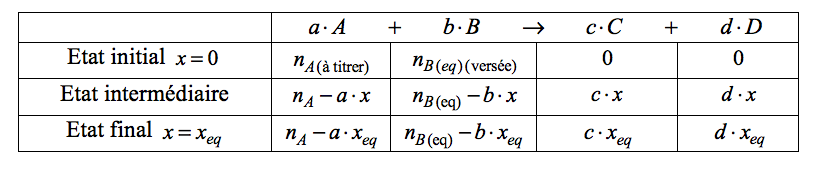
En combinant ces deux relations, nous déduisons la relation à l'équivalence :
En outre, nous avons nA = cA × VA et nB = cB × VB(eq)où VB(eq) est le volume de B versé à l'équivalence.
Les concentrations cA et cB sont en mol/L, les volumes VA et VB(eq) en L.
→ Titrage donnant lieu à l’établissement d’une courbe de titrage
La courbe rend compte de l’évolution d’une grandeur physique en fonction du volume VB versé :
• Titrage conductimétrique (voir fiche dédiée) : on étudie comment évolue la conductance G ou la conductivité σ de la solution en fonction de VB. Ce type de titrage est utilisable pour titrer une espèce chimique ionique.
À l’équivalence, G ou σ sont très souvent minimales.
• Titrage pH-métrique (voir fiche dédiée) : on suit comment évolue le pH en fonction de VB. On peut l’utiliser pour titrer un acide ou une base.
À l’équivalence, le pH varie brutalement.
→ Titrages colorimétriques
Dans ce type de titrage, l’équivalence se repère par un changement de couleur, l’apparition d’une coloration ou la disparition d’une coloration :
• Utilisation d’indicateurs colorés, dont les couleurs dépendent du pH. Lors d’un titrage acido-basique, on peut ajouter quelques gouttes de l’indicateur coloré adapté, qui change de couleur à l’équivalence.
• Si le réactif titré A est coloré, la disparition de la coloration de la solution marque l’équivalence. Exemple : titrage du diiode, de couleur jaune-brun.
• Si le réactif titrant B est coloré, sa coloration ne persiste dans le bécher qu’à partir de l’équivalence. Voir partie 5 pour un exemple.
• Titrage par précipitation ou complexation. Exemple : méthode de Mohr pour le titrage des ions chlorure (vu en spécialité).
→ Si la solution de A a été obtenue par une dilution, ne pas oublier de multiplier par le facteur de dilution, afin de remonter à la concentration de la solution mère (avant dilution).
→ Si la finalité du titrage est de valider une concentration théorique cth , on effectue un calcul d’écart relatif :
ε est un pourcentage. La valeur trouvée est acceptable si ε < 5 % .
Exemple : déterminer la concentration d’une solution commerciale, pour valider ou pas la concentration cth donnée par l’étiquette du produit étudié.
→ Mener un calcul d’incertitude. En se limitant au titrage lui-même, l’incertitude absolue ∆cA (en mol/L) de cA est donnée par la relation (non exigible) :
où ∆cB (en mol/L), ∆VB(eq)(en L) et ∆VA(en L) sont les incertitudes absolues liées respectivement à la concentration de l’espèce titrante B, à son volume versé à la burette et au volume de solution titrée A. On écrit le résultat comme cA ± ∆cA.
L’ion permanganate MnO4– est de couleur violette. C’est la seule espèce colorée dans cette manipulation. Avant l’équivalence, c’est le réactif limitant de la réaction support du titrage : la solution contenue dans le bécher reste incolore. Dès que l’on dépasse l’équivalence, MnO4– n’est plus consommé dans le bécher, et il donne alors une coloration rose, violette. On détecte donc l’équivalence par une méthode colorimétrique. On trouve VB(eq) ≈ 19,3 mL.

La relation d'équivalence est donc :
Application numérique :
La réaction entre A et B est la réaction support du titrage a × A + b × B → c × C + d × D .
Elle doit être rapide, totale et unique.
À l’équivalence, les deux espèces A et B on été introduites en proportions stœchiométriques, et on écrit alors la relation à l’équivalence :

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








