Applications à des titrages mettant en jeu des réactions acido-basiques
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
De nombreuses méthodes peuvent être mises en place :
• titrage direct colorimétrique par ajout d’un indicateur coloré ;
• titrage direct pH-métrique ;
• titrage conductimétrique ;
• titrage indirect par excès de titrant.
Certaines de ces méthodes sont présentées ici.
Montage expérimental :
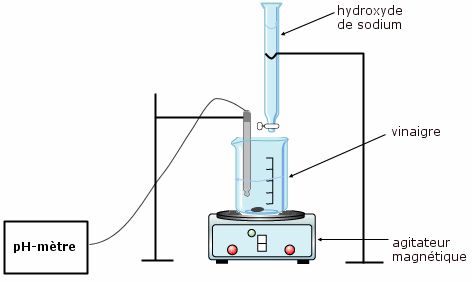
Il y a peu de changement de couleur mais il faut faire attention à maintenir l’agitation à chaque ajout et à laisser se stabiliser la valeur de pH avant de la reporter directement (pas de tableau de valeurs) sur le papier millimétré.
La courbe obtenue est ascendante et présente deux points d’inflexion.
Équation :
L’acide éthanoïque réagit très peu avec l’eau donc la réaction totale qui a lieu est :
CH3COOH(aq) → CH3COO-(aq) + H+ ;
HO-(aq) + H+(aq) → H2O.
Bilan : CH3COOH(aq) + HO-(aq) → CH3COO-(aq) + H2O(aq).
Exploitation d’une courbe pH-métrique :
Deux méthodes permettent de déterminer Veq et pHeq sur la courbe obtenue :
• la méthode des tangentes : l’intersection du milieu de la perpendiculaire aux deux tangentes aux deux points d’inflexion parallèles avec la courbe a pour coordonnées : E(Veq ; pHeq).
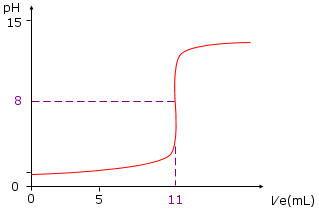
On obtient pour ce graphique : VBeq = 11 mL de base versée à pHeq = 8.
Détermination de la concentration :
| Equation de la réaction | CH3COOH(aq) + HO-(aq) → CH3COO-(aq) + H2O(aq) | ||||
| Etat de système | Avancement | nCH3COOH | nOH- | nCH3COO- | excès |
| Etat initial (t=0) (mmol) | 0 | CA'.VA' | CB.VB versé : au départ 0 | 0 | excès |
| Etat intermédiaire (t) (mmol) | x | CA'.VA' | CB.VBversé - x | x | excès |
| Etat équivalence (mmol) | xeq | CA'.VA' - xeq = 0 | C2.V2 - xeq = 0 | xeq | excès |
D'où xeq = CA'.VA'/1 et xeq = C2.V2eq/1 d'après la dernière ligne de tableau d'avancement.
De plus, n = C.V donc CA'.VA' = C2.V2 eq.
CA'=
Donc dans le vinaigre, CA = 10.CA' = 1,1 mol.L-1 d'acide éthanoïque.
Montage expérimental :
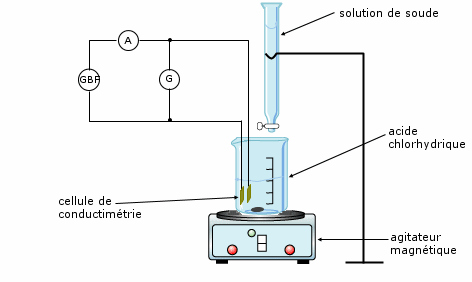
On trace directement sur papier millimétré G = f(VB) car les solutions restent incolores.
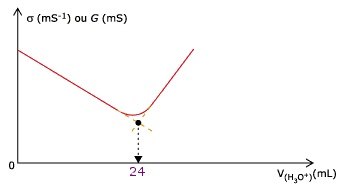
La conductance G diminue puis augmente au cours du titrage.
Equation et interprétation de la courbe conductimétrique :
H3O+(aq) → H+(aq) + H2O.
HO-(aq) + H+(aq) → H2O.
Bilan : H3O+(aq) + HO-(aq) → 2H2O(aq) .
Remarque : les ions chlorure Cl- et sodium Na+ sont des ions spectateurs.
Interprétation et exploitation de la courbe conductimétrique :
Au départ, la solution contient de nombreux ions hydronium H3O+(aq), d’où la forte conductance initiale. Mais au fur et à mesure des ajouts d’ions hydroxyde HO-(aq), réagissant pour former de l’eau, la concentration des espèces ioniques diminue.
Donc la conductance G diminue.
Après l’équivalence, il n’y a plus d’ions H3O+(aq) et les ajouts d’HO-(aq) se poursuivent.
La conductance augmente à nouveau.
Il est indiqué 200 mg/gélule sur une boîte, vérifions cette indication.
On réalise ensuite un titrage colorimétrique de l’excès d’ions hydroxyde (Texcès), n’ayant pas réagit avec l’ibuprofène, par de l’acide chlorhydrique (R) de concentration CR = 5.10-2 mol.L-1.
L’équivalence est repérée grâce à un indicateur coloré adapté à pHeq = 7,0 pour un volume d’acide chlorhydrique versé VReq = 16,8 mL.
| Indicateur | Forme acide IndH(aq) | Zone de virage | Forme basique Ind-(aq) |
| Rouge de bromophénol | Jaune | 5,2 à 6,8 | Pourpre |
| Bleu de bromothymol (BBT) | Jaune | 6 à 7,6 | Bleu |
| Phénolphtaléïne | Incolore | 8,2 à 9,8 | Rose |
L'indicateur coloré sera le BBT car sa zone de virage comprend le pHeq et le passage du jaune au bleu sera significatif.
AH(aq) + HO-(aq) → A-(aq) + H2O(aq).
(X) (Tr)
Seule la partie (Tr) des ions hydroxyde a réagi avec (X) sur la totalité introduite Ti donc il reste :
nTexcès (HO-) → nTi(HO-) - nTr (HO-).
Les ions hydroxyde en excès (Texcès) vont être titrés par les ions oxonium H3O+(aq) selon l’équation :
H3O+(aq) + HO-(aq) → 2H2O(aq).
nTexcès (HO-) = nR (H3O+)(eq).
nTexcès (HO-) = CR.VReq = 5.10-2.16,8.10-3 = 8,4.10-4 mol.
Pour trouver la quantité d’ions hydroxyde (Tr) ayant effectivement réagi avec l’ibuprofène (X), on fait la différence :
nTr (HO-) = nTi (HO-) - nTexcès (HO-) avec nTi (HO-) = Ci.Vi = 9.10-3.0 ,2 = 1,8.10-3 mol.
donc nTr (HO-) = 1,8.10-3 - 8,4.10-4 = 9,6.10-4 mol.
D’après la première équation de réaction n(AH) = nTr (HO-) = 9,6.10-4 mol.
Il reste à déterminer la masse correspondante pour la comparer à l’étiquette :
m(AH) = n(AH).M(AH) = 9,6.10-4. 206 = 198 mg.
L’indication du fabricant est donc correcte.
Les mesures pH-métriques et conductimétriques peuvent donner des courbes exploitables donnant des résultats assez précis.
Le titrage indirect est moins courant mais se réalise souvent grâce à un titrage colorimétrique pour la seconde réaction.

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








