La structure des enzymes
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
Quelles sont les caractéristiques structurales des enzymes qui permettent d'expliquer leur fonctionnement ?
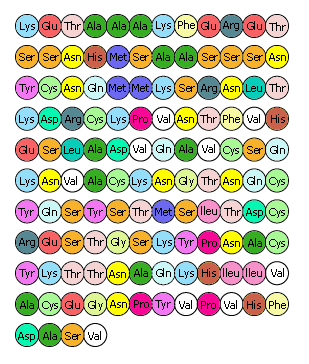
On appelle structure primaire l'ordre dans lequel les acides aminés sont disposés linéairement dans la chaîne protéique. Si l'on comparait l'enzyme à un collier de perles de couleurs et d'aspects différents, chaque perle correspondant à l'un des vingt acides aminés, on obtiendrait la structure primaire en étalant le collier de perles dans un plan et en décrivant une à une les perles dans un ordre précis, par exemple de la gauche vers la droite.
Des interactions électrostatiques (liaisons
hydrogènes) replient les chaînes peptidiques en
feuillets et en hélices.
- Par exemple, la présence de proline (un des 20
acides aminés) coude la chaîne.
- Des interactions hydrophobes, des interactions entre
groupement ionisés « tordent » la
chaîne de différentes façons.
- Des liaisons covalentes entre les résidus d'acides aminés soufrés (ponts disulfures) stabilisent la molécule.
Des facteurs physico-chimiques peuvent altérer ces liaisons et modifier la forme de l'enzyme, ce qui entraîne souvent une perte de fonction : la réaction chimique n'est plus catalysée. La structure de l'enzyme est indissociable de son action. La structure est fragile, elle n'existe que dans une gamme de température et de pH précis.
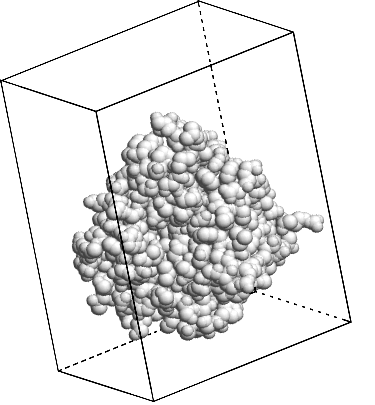
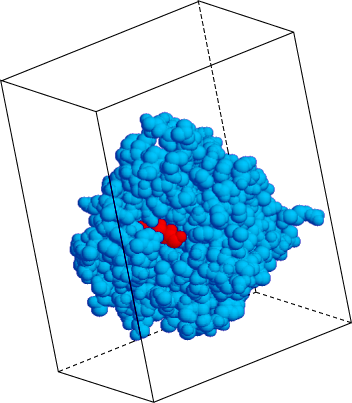
On étudie des diagrammes de diffraction des rayons X (obtenus le plus souvent par rayonnement synchrotron) pour construire les modèles moléculaires à l'aide de calculs complexes.
La « protéomique » (étude du protéome = ensemble des protéines d'un individu) est une voie d'avenir : à partir de la séquence primaire d'acides aminés, cette science vise à modéliser, par des calculs complexes, les structures tridimensionnelles des molécules protéiques.
Les gènes contrôlent la structure primaire
d'une enzyme comme de toute autre protéine.
Cette structure primaire, caractérisée
par l'ordre d'enchaînement des acides aminés,
conditionne la structure tridimensionnelle de
l'enzyme. Des liaisons faibles entraînent le
reploiement de la molécule et déterminent
un site actif capable de se lier avec une partie du
substrat.
Si la structure primaire de l'enzyme est
altérée, cela peut entraîner des
modifications dans la structure du site actif de telle
sorte que la catalyse ne puisse plus s'effectuer. D'autre
part des variations des conditions physico-chimiques
(température, pH) aboutissent à la rupture ou
à la création de nouvelles liaisons chimiques
susceptibles d'altérer la forme initiale de
l'enzyme.
En définitive, la forme d'une protéine
enzymatique est fondamentale car elle conditionne son
activité catalytique. Structure et fonction sont
intimement liées.

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !









