L'activité des enzymes
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
Quelles sont les caractéristiques de l'activité des enzymes, ces performants biocatalyseurs ?
Cette spécificité des enzymes n'est toutefois pas absolue. Les peroxydases agissent sur des substrats différents.
Des enzymes distinctes agissant sur un même substrat ne se lient généralement pas avec la même partie de la molécule.
Une déshydrogénase catalyse une oxydation par retrait d'hydrogène, une carboxylase catalyse une réaction de carboxylation, c'est-à-dire de fixation de CO2 sur le substrat.
Certaines enzymes catalysent deux types de réactions chimiques. La Rubisco, abondante dans les cellules chlorophylliennes permet la fixation du CO2 dans les molécules organiques et aussi l'oxygénation du ribulose biphosphate.
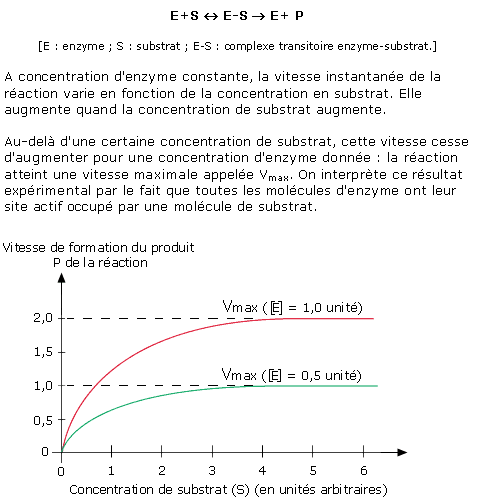
Il existe des inhibiteurs des enzymes. Ils présentent des similitudes avec certaines parties du substrat et se fixent sur le site actif à la place du véritable substrat. L'activité de l'enzyme est alors fortement diminuée voire totalement inhibée.
- Le monoxyde de carbone et le cyanure se fixent par liaison chimique forte de type covalente de façon irréversible sur le site actif de la cytochrome oxydase, une enzyme respiratoire (comme de la colle qui bloquerait définitivement une serrure) ; ce sont des inhibiteurs non compétitifs. D'un point de vue cinétique, tout se passe comme si l'inhibiteur non compétitif diminuait la concentration d'enzyme.
- Beaucoup de médicaments ou de stimulants (Viagra, café...) sont des inhibiteurs compétitifs : ils entrent en compétition avec le substrat pour occuper provisoirement le site actif des molécules d'enzyme. Avec ce type de molécules, si on maintient une concentration fixe de l'enzyme, la vitesse maximale de la réaction catalysée reste constante. Pour des concentrations élevées en substrat les molécules d'inhibiteur se trouvent diluées dans le substrat. D'un point de vue cinétique, tout se passe comme si l'inhibiteur compétitif diminuait la concentration de substrat.


Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !









