Extraction d'une espèce chimique d'un solvant
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
Par exemple, on dispose d’une solution aqueuse de diiode
De manière générale, un solvant organique est composé de molécules formées à partir d’une chaîne carbonée (hydrocarbures, alcools, …). Le mélange est versé dans une ampoule à décanter. On agite le mélange et on laisse reposer.
Le cyclohexane n’étant pas une molécule polaire, sa miscibilité avec l’eau est nulle. On note donc l’apparition de deux phases (deux zones) bien distinctes. Quelquefois, l’ajout de certaines espèces chimiques (chlorure de sodium) permet d’accentuer la séparation. Le cyclohexane forme la phase organique et l’eau la phase aqueuse.
La densité d’un corps est sa masse volumique divisée par la masse volumique de l’eau. L’eau a par définition une densité de 1. Le cyclohexane a une densité de 0,78. Le cyclohexane constitue donc la phase la plus haute, l’eau sera placée en dessous.
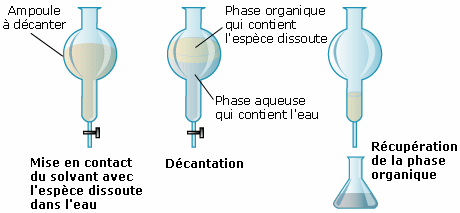
Le diiode est plus miscible dans le cyclohexane que dans l’eau : durant la manipulation, il va migrer dans la phase organique (cyclohexane), qu’il colore en rose. La phase aqueuse devient incolore. On a donc extrait le cyclohexane de la phase aqueuse. On ouvre le robinet de l’ampoule à décanter afin d’évacuer la phase aqueuse, et ensuite récupérer la phase organique contenant le diiode.
L’extraction liquide/liquide peut s’employer après une réaction chimique, afin d’opérer une première séparation entre les espèces chimiques du milieu réactionnel, en extrayant celle qui nous intéresse.
Cependant, l’espèce extraite se trouve encore dans le solvant extracteur en fin de manipulation. L’extraction liquide/liquide est souvent suivie d’une autre opération visant à se débarrasser de ce solvant.
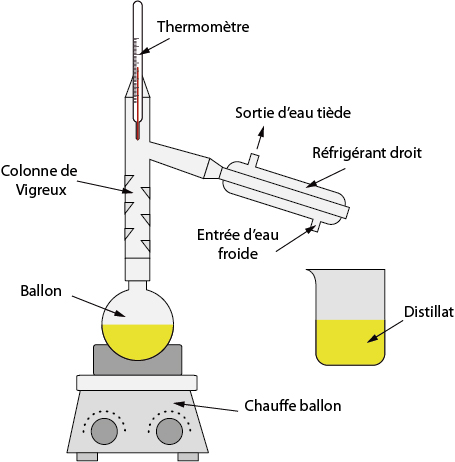
Le mélange est porté à ébullition dans un chauffe-ballon, les vapeurs vont passer à travers une colonne de Vigreux. Les vapeurs formées par l’espèce chimique ayant la température d’ébullition la plus basse vont traverser, pour ensuite être condensée par le réfrigérant droit, et retomber dans un bécher. Le liquide récupéré s’appelle le distillat.
Il est important que la température de chauffage soit contrôlée (thermomètre) et bien homogène (pierre ponce dans le ballon). On se place à une température intermédiaire entre les températures d’ébullition des deux espèces à séparer. Si cette contrainte est respectée, l’espèce chimique ayant la température d’ébullition la plus haute restera dans le ballon, et la séparation sera correctement effectuée.
Cette manipulation peut intervenir après une extraction liquide/liquide avec ampoule à décanter, si on souhaite séparer le produit à récupérer du solvant. Par exemple, quand on synthétise un ester (molécule odorante), celui-ci se retrouve mélangé avec des traces d’alcool et de solvant organique. La distillation fractionnée est alors potentiellement applicable. Par contre, on ne fera pas de distillation fractionnée pour récupérer un solide dissous.
L’évaporation de certains solvants est employée dans des manipulations. Ainsi, après une extraction liquide/liquide avec l’ampoule à décanter, il est quelquefois possible de laisser s’évaporer le solvant extracteur, afin de récupérer l’espèce chimique voulue. Le dichlorométhane
Ainsi, si on a synthétisé une espèce chimique sous la forme d’un solide dissous, abaisser la température du mélange permet de saturer la solution, et ainsi de faire cristalliser le solide à extraire. La solution devient souvent opaque. La plupart du temps, la cristallisation n’est pas suffisante pour le récupérer.
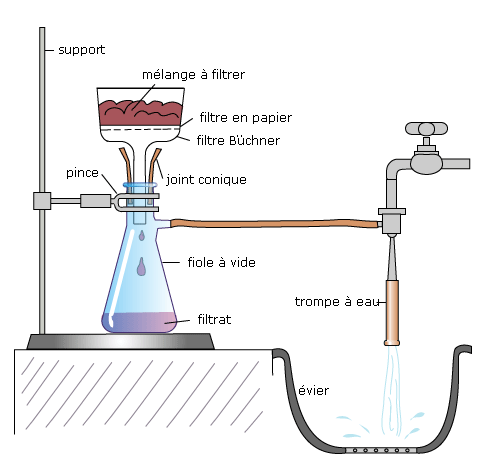
La synthèse de l’aspirine en travaux pratiques fait intervenir une filtration sous vide comme dernière étape de la manipulation. L’aspirine est recueillie dans le papier filtre sous la forme d’un solide blanc.
Si l’espèce chimique à extraire est sous forme liquide, on peut procéder à une extraction liquide/liquide avec une ampoule à décanter. Le principe de la manipulation est de verser dans la solution un solvant non miscible avec le solvant déjà présent, et ayant plus d’affinité que lui avec l’espèce chimique à extraire. Deux phases distinctes et séparables se formeront ; on gardera celle correspondant au solvant versé, qui aura extrait l’espèce chimique que nous voulions.
La distillation fractionnée consiste à porter à ébullition un mélange de deux espèces chimiques afin de les séparer. Pour être efficace, cette méthode requiert que les deux espèces aient des températures d’ébullition différentes.
Si l’espèce chimique est un solide dissous, une première étape consistera à le faire cristalliser. Pour cela, la plupart du temps, il suffit de refroidir le mélange afin d’abaisser sa solubilité dans le solvant. Une filtration sous vide avec entonnoir Büchner aspire le liquide et permet de récupérer le solide cristallisé.

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








