Variation de température et transformation physique par transfert thermique
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
• Un liquide est constitué de molécules glissant les unes sur les autres. Ces molécules interagissent entre elles par liaisons hydrogène (exemple de l’eau) ou liaisons de van der Waals. Ces liaisons se font et se défont sans cesse, mais assurent la cohésion compacte du liquide. De hautes températures font que les molécules sont plus mobiles qu’à basses températures et vibrent. Les liaisons sont alors plus éphémères.
• Un solide cristallin est formé par des atomes ou molécules (pour solide moléculaire) liés entre eux par des liaisons chimiques stables. A très basses températures, les atomes/molécules sont immobiles. Dès que la température s’élève, ils vibrent. Plus la température augmente, plus les vibrations sont importantes, mais les atomes/molécules restent proches de leur position d’équilibre.
Globalement, une élévation de température augmente l’agitation thermique des constituants (atomes, molécules) d’un corps. On parle d’énergie microscopique.
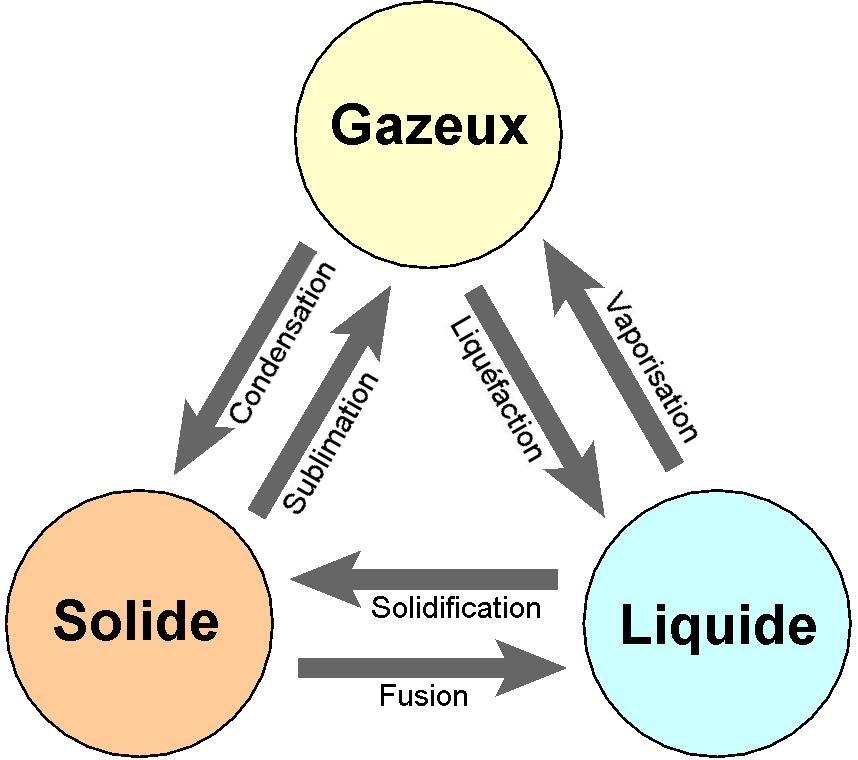
Au niveau microscopique, un passage de l’état solide à l’état liquide s’accompagne d’une rupture des liaisons entre molécules, qui sont alors libres de se déplacer dans le liquide. Cependant, elles ne le quittent pas, car des liaisons hydrogènes ou van der Waals les en empêchent.
Un passage d’un état liquide à un état gazeux correspond à une rupture de ces liaisons de basses énergies. Les molécules n’ont alors plus de lien entre elles et quittent le liquide pour former la phase aqueuse.
La sublimation est un changement d’état où les liaisons chimiques assurant la cohésion du solide sont rompues et aucune autre liaison n’existe alors entre les atomes/molécules qui passent directement en phase gazeuse. La sublimation est rare à pression ambiante, sauf pour la neige carbonique. Pour l’eau, la sublimation n’est possible qu’à très basses pressions (comètes).
Les autres changements d’état correspondent aux opérations inverses de ce que nous venons de décrire.
L’unité légale pour exprimer une énergie est le Joule. Cependant, une unité usuelle encore rencontrée (en nutrition) est la calorie. Une kilocalorie, notée aussi Calorie (attention à la majuscule), vaut environ 4,184 kJ.
L’unité de température est le kelvin (K). Une température T en kelvin est reliée à une température
La relation est valable tant que le corps ne subit pas de changement d’état physique. La quantité de chaleur Q est en Joule.
Il est courant d’utiliser la capacité thermique massique c :
c désigne l’énergie qu’il faut apporter à un kilogramme du corps pour élever sa température d’un kelvin. Elle s’exprime en
On emploie aussi la capacité thermique molaire
Remarque : Une variation d’un kelvin est égale à une variation d’un degré Celsius. On peut donc exprimer dans
Lorsqu’un liquide est à sa température d’ébullition, l’énergie thermique Q à fournir au liquide de masse m afin de le faire passer en phase gazeuse est donnée par la relation :
La relation sera utilisée à pression constante (pression atmosphérique). La constante
De la même manière, la chaleur latente de fusion
Naturellement, il existe aussi la chaleur latente de sublimation
Remarque : On peut également raisonner avec des chaleurs latentes molaires.
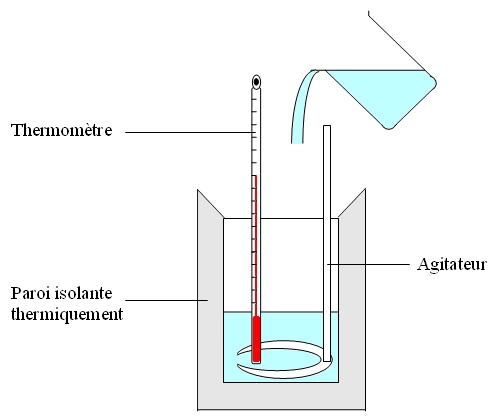
Cette enceinte est isolée thermiquement pour minimiser les échanges thermiques avec le milieu environnant. Dans une manipulation, on détermine au préalable la capacité thermique C du calorimètre pour l’inclure dans les calculs.
où
NB : pour ce calcul, le système a été considéré comme totalement isolé, ce qui n’est jamais totalement réalisé.
En conséquence :
D’où on tire
Application numérique :
Une élévation de température augmente l’agitation thermique des constituants (atomes/molécules) de la matière. La variation d’énergie thermique Q est reliée à la variation de température
La constante C est la capacité thermique du corps étudié, sous un certain état physique. On introduit alors la capacité thermique massique
La chaleur latente de vaporisation
Une énergie reçue par un système physique est comptée positivement, une énergie cédée est comptée négativement. Lorsque deux corps sont mis en présence dans une enceinte isolée thermiquement (calorimètre), il y a équilibre thermique lorsque les quantités de chaleur échangées

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








