Electronégativité et polarité
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
Pour être stables, les autres éléments chimiques peuvent satisfaire la règle de l’octet ou du duet en mettant en commun des électrons avec d’autres atomes dans la même situation. Il y a ainsi formation de doublets liants d’électrons.
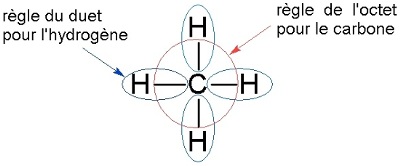
Cela constitue les liaisons chimiques. Il en existe plusieurs catégories :
• Les liaisons métalliques.
• Les liaisons covalentes.
• Les liaisons ioniques.
Les liaisons métalliques sont un cas très particulier de liaisons chimiques car les électrons assurant la cohésion du métal ne restent pas localisés entre deux atomes, mais sont mobiles à l’intérieur du solide entier. Cela explique la conduction électrique des métaux.
Remarque : les liaisons de basses énergies (liaisons hydrogène et liaisons de Van der Waals) ne constituent pas un échange d’électrons, ce qui les exclut de notre liste.
Quand les atomes sont différents, le partage peut être moins équitable. On définit l’électronégativité comme « l’avidité » d’un atome en électrons intervenants dans une liaison chimique. Si deux atomes d’électronégativités voisines établissent une liaison chimique, les électrons resteront bien répartis entre les deux atomes. On reste dans le cadre des liaisons covalentes, comme pour la liaison C–H.
Par contre, une liaison formée avec deux atomes ayant une forte différence d’électronégativité ne sera pas équitable. Ce sera une liaison ionique. Par exemple, la liaison Na–Cl est typiquement une liaison ionique, assurant la cohésion du cristal de chlorure de sodium (sel de cuisine). Notons que la frontière entre liaison covalente et liaison ionique n’est pas nette.
L’échelle de Pauling est une échelle classant les éléments chimiques selon leur électronégativité.
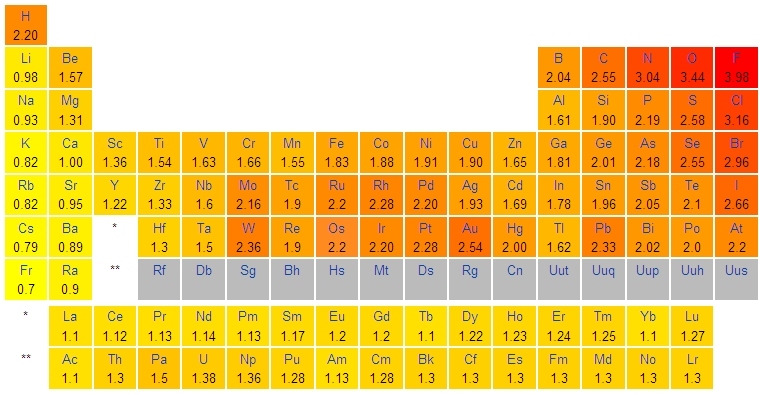
Le fluor est l’élément le plus électronégatif. Dans la classification périodique des éléments, l’électronégativité décroît en se déplaçant vers la gauche et/ou vers le bas.
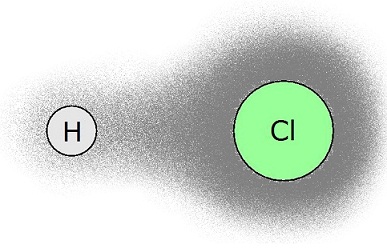
Ainsi, en moyenne, c’est comme si l’atome de chlore présentait une charge électrique formelle négative
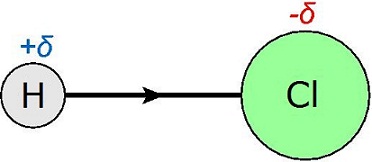
Ces charges, en valeur absolue, sont inférieures à la charge électrique élémentaire e, sinon les deux atomes seraient ionisés et la liaison chimique rompue.
En résumé, pour une molécule diatomique, quand une liaison chimique est établie entre deux atomes ayant des électronégativités très différentes, la liaison n’est pas équitable. En conséquence, les atomes participants à la liaison présentent des charges électriques partielles. La molécule est polaire. Elle constitue un dipôle électrostatique. Cependant, elle reste globalement neutre.
D’une manière générale, pour des molécules plus complexes, on pourra retentir qu’une molécule est polaire si le barycentre des charges formelles positives n’est pas confondu avec celui des charges formelles négatives.
Dans le cas contraire, la molécule est dite apolaire. Une molécule est apolaire si elle ne comporte pas de liaisons notablement polarisées, comme le méthane
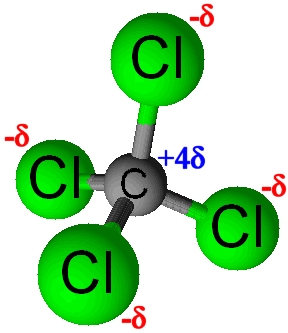
Le barycentre des charges négatives se trouve au centre du tétraèdre, c'est-à-dire au niveau de l’atome de carbone portant la charge
 .
.La molécule d’eau est coudée, à cause des doublets non liants de l’oxygène. D’autre part, l’oxygène est nettement plus électronégatif que les hydrogènes. Il draine les électrons des deux liaisons vers lui. Cela veut dire que l’eau est porteuse de charges électriques partielles :
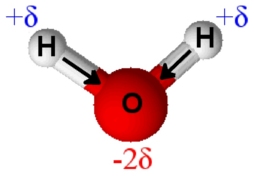
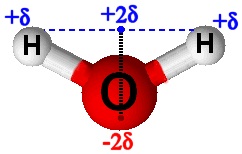
On conclut alors que le barycentre des charges + et celui des charges – ne sont pas confondus, ce qui confirme que l’eau est une molécule polaire.
L’exemple de l’eau est important car l’eau est un solvant. On rappelle qu’un solvant est un liquide dans lequel il est possible de dissoudre des espèces chimiques. Il sera vu dans la fiche traitant de la dissolution le mode d’action de l’eau…
L’électronégativité traduit l’affinité d’un atome par rapport aux électrons qui participent à une liaison chimique. Deux atomes ayant une électronégativité proche ou égale forment une liaison ou les électrons sont échangés de manière équitable (liaison covalente).
Deux atomes qui ont une forte différence d’électronégativité forment une liaison ionique, où les électrons sont le plus souvent proches de l’atome ayant la plus forte électronégativité. Les atomes portent alors des charges électriques partielles. Pour une molécule diatomique, elle forme alors un dipôle électrostatique. La molécule est dite polaire, mais elle est neutre électriquement.
D’une manière générale, une molécule est apolaire si le barycentre des charges partielles positives est confondu avec le barycentre des charges partielles négatives. Dans le cas contraire, la molécule est dite polaire. La molécule d’eau est une molécule polaire. Elle constitue un solvant polaire.

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








