Piles et accumulateurs dans le défi énergétique
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
Pour les piles salines, on a vu que l’anode était constituée de zinc en contact avec un électrolyte acide (chlorure d’ammonium). Ainsi, le zinc pourrait être attaqué par l’acide, ce qui libèrerait du dihydrogène gazeux, et ferait exploser la pile. Pour résoudre ce problème, le zinc a été amalgamé par du mercure. Cela consiste en un alliage superficiel entre le zinc et le mercure. D’autre part, des piles boutons utilisaient du mercure en tant que couple rédox avec de l’oxyde de mercure :
Cependant, l’utilisation de mercure dans les piles a été interdite durant les années 90, sauf dans à l’état de traces et dans les piles boutons où il peut subsister un pourcentage de mercure.
Plus récemment, une pile zinc-air a été mise au point. Celle-ci utilise toujours le zinc, mais l’oxydant est le dioxygène de l’air, d’où son nom. Cela diminue naturellement l’emploi de matériaux chers et/ou toxiques. Par contre, elle permet de délivrer plus d’énergie qu’une pile ordinaire.
A l’anode, le zinc est oxydé :
A la cathode, le dioxygène est réduit :
Ces piles sont utilisées dans les appareils auditifs, ou sur certaines installations fixes (signalisation ferroviaire …).
Depuis 1970, le remplacement du zinc par d’autres métaux plus réducteurs comme le lithium a été étudié. La pile bouton au couple Lithium-dioxyde de manganèse
Afin de prendre en compte la masse de la batterie, la notion d’énergie massique est alors employée. C'est l’énergie électrique restituée par la batterie divisée par sa masse et s’exprime habituellement en Wattheure par kilogramme (
Par exemple, une batterie de
• Le plomb est un métal lourd. Il est toxique pour les être vivants, y compris les humains (saturnisme).
• La batterie au plomb est lourde. Son énergie massique est basse comparée à ses rivales, de valeur
Le second argument est sans jeu de mots un argument de poids. En effet, un véhicule électrique dont la batterie fournirait une énergie électrique totale de
Dans ce cadre là, on rencontre principalement trois types d’accumulateurs :
• Les accumulateurs nickel-cadmium (NiCd), d’énergie massique entre 45 et 80 Wh/kg.
• Les accumulateurs nickel-métal-hydrure (Ni-MH), où on a entre 60 et 110 Wh/kg.
• Les accumulateurs lithium-ion (Li-ion), de forte énergie massique : 90-180 Wh/kg.
Les accumulateurs utilisés à la place des piles sont plus chers à l’achat que celles-ci, et demandent de posséder un chargeur. Ils peuvent se décharger partiellement quand ils ne sont pas employés (autodécharge). Certains sont constitués de métaux lourds et/ou toxiques. Les accumulateurs Ni-Cd contiennent du Cadmium toxique, ce qui a amené à son interdiction dans certaines applications. D’une manière générale, il est nécessaire qu’ils soient collectés en fin de vie pour traitement et recyclage.
Mais, l’amortissement financier est vite réalisé, surtout si les accumulateurs sont employés dans des appareils fonctionnant souvent et/ou « gourmands » en énergie. Aussi, comme les piles jetables ne sont pas totalement recyclables, l’impact environnemental des accumulateurs est nettement moindre. Ils génèrent moins de déchets, puisqu’un accumulateur peut être rechargé jusqu’à environ 1000 fois. Sa durée de vie est de quelques années.
Au-delà de l’emploi en tant que pile, les accumulateurs sont utilisés dans les téléphones et ordinateurs portables (batteries Ni-MH, Li-ion ou lithium polymère), les véhicules électriques (Li-ion), ... D’autres accumulateurs sont à l’étude, comme les Li-air, et pourraient atteindre une énergie massique de 1500 à 2500 Wh/kg !
Les piles à combustibles sont une solution afin de concilier ces deux approches. Elles utilisent un combustible et un comburant afin de produire directement l’électricité. Le principe de fonctionnement a été établit en 1839. Cependant, elles ne furent employées que dans les années 50-60, afin d’alimenter les ordinateurs embarqués lors des missions spatiales Gemini et Apollo de la NASA.
Une pile à combustible se compose d’un assemblage de plusieurs éléments, d’où le terme de pile. On a représenté ci-dessous un élément de pile à combustible utilisant le dihydrogène
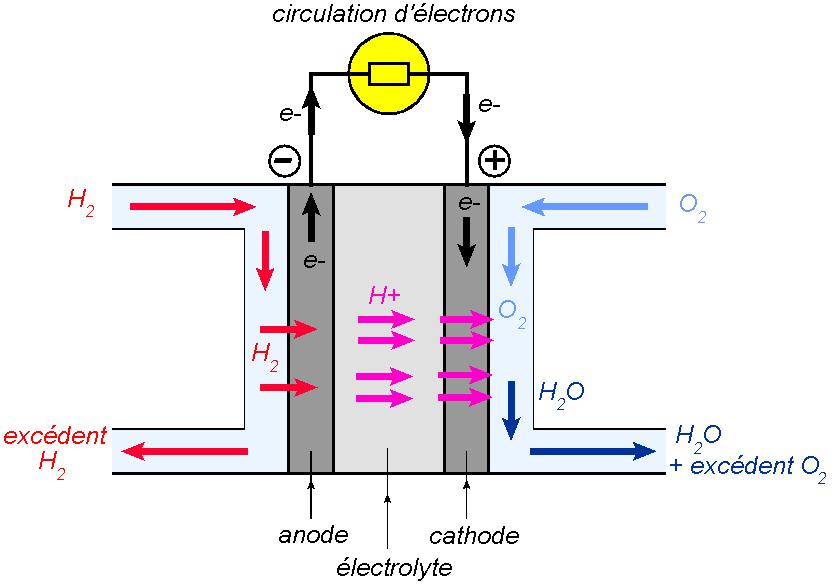
Au niveau de l’anode, le dihydrogène est oxydé selon la demi-équation :
Les électrons sont collectés et envoyés dans le circuit électrique. Les ions
La réaction globale a le même aspect que la combustion du dihydrogène dans le dioxygène :
L’eau produite par la pile à combustible ne constitue bien entendu aucune source de pollution, ce qui fait de la pile une source d’énergie propre.
Mais, un point faible d’une pile à combustible est le platine utilisé comme catalyseur, cher et polluant. Des études récentes cherchent à diminuer sa présence ou à le remplacer.
Une autre difficulté se situe en amont, pour produire le dihydrogène. Il s’obtient par hydrolyse de l’eau (très couteuse énergétiquement), ou par des combustibles fossiles (vaporeformage) mais au prix de rejets de
D’autres modèles de piles à combustibles sont à l’étude, utilisant d’autres combustibles, comme des alcools. La recherche dans le domaine des piles à combustible est active.
Afin de comparer l’efficacité énergétique d’un accumulateur, la notion d’énergie massique est utilisable. Elle peut s’exprimer en
Les piles à combustibles utilisent un combustible et un comburant afin de convertir directement l’énergie chimique en énergie électrique, à la différence d’une machine thermique.

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








