L'isomérisation photochimique
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
• Bref rappel des notions pertinentes de chimie organique.
• Exemple d’isomérisation photochimique à travers une manipulation reproductible en Travaux Pratiques.
• Remarquer que l’isomérisation photochimique explique le mécanisme de la vision.
• Les alcools : un alcool correspond au groupement hydroxyle –OH greffé sur un carbone tétragonal, c’est-à-dire comportant quatre liaisons simples. Pour un alcool primaire (–OH relié à un carbone lui-même relié à un seul autre carbone), on a la structure générale :
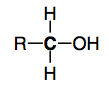
Ils se nomment via le suffixe –ol.
Le β-carotène se présente sous la forme suivante :
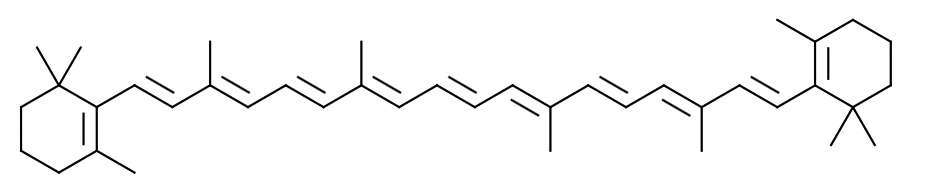
C'est un pigment orange. Il donne d’ailleurs sa couleur aux flamants roses.
Ainsi, les deux configurations suivantes sont différentes :
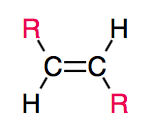
|
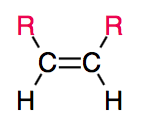
|
| E | Z |
On obtient :
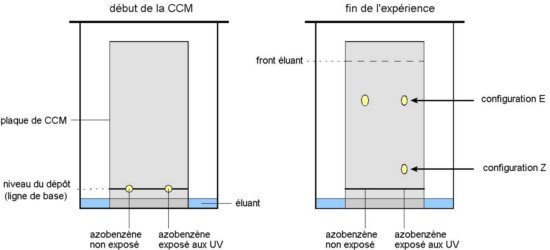
L’échantillon à l’abri de la lumière (témoin) ne présente qu’une seule tâche jaune, associée à l’isomère E naturel. Par contre, l’échantillon exposé présente deux tâches jaunes. Celle qui est à la même hauteur que l’échantillon témoin est bien entendu l’isomère E. Par contre, l’autre tâche correspond à l’isomère Z. Nous en déduisons que l’exposition aux UV a conduit a une photo-isomérisation.
En effet, une double liaison empêche la rotation. Cependant, si un photon (particule lumineuse) vient frapper cette double liaison, il peut la rompre provisoirement. Pendant un cours laps de temps, avant que la liaison se reforme, la rotation selon son axe est permise.
Dans le cas de l’azobenzène, l’isomère Z résulte d’une telle rotation, à partie de l’isomère E :
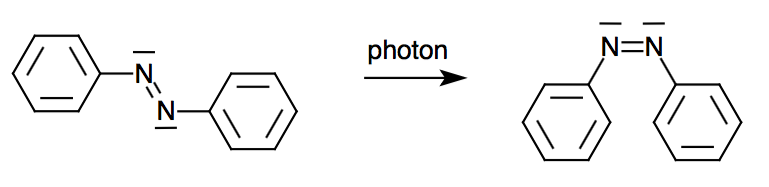
|
|
| (E)-azobenzène | (Z)-azobenzène |
La forme Z est moins stable que la forme E, à cause des deux cycles benzéniques qui occupent un certain volume dans l’espace (encombrement stérique).
En configuration Z, les deux cycles se gênent mutuellement, d’où la structure non plane. Cela explique pourquoi l’échantillon initial ne comportait que du E.
D’un point de vue chimique, au niveau des récepteurs photosensibles, le mécanisme de la vision repose sur une isomérisation photochimique, comme celle vue dans notre exemple.
La vitamine A, ou rétinol, est apportée par l’alimentation directement ou sous la forme de β -carotène (la molécule, en se « cassant » en deux morceaux, forme du rétinol).
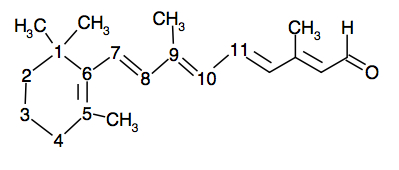
La vitamine A se présente comme ceci :
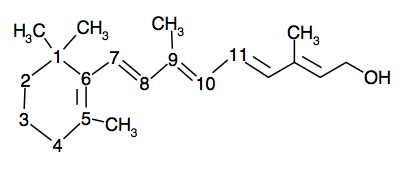
Elle est en configuration E. Sous l’effet de réactions chimiques, elle forme l’isomère Z, appelé 11-(Z)-rétinol :
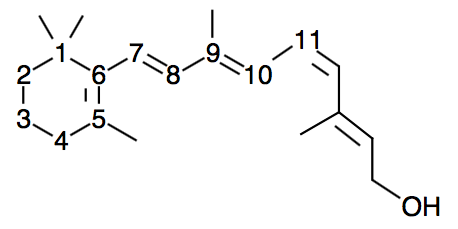
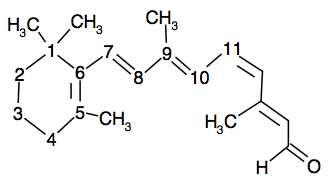
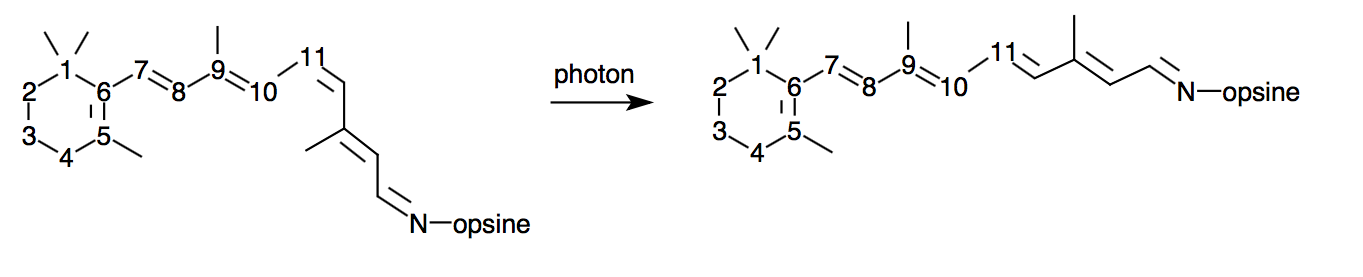
En voici le bilan :
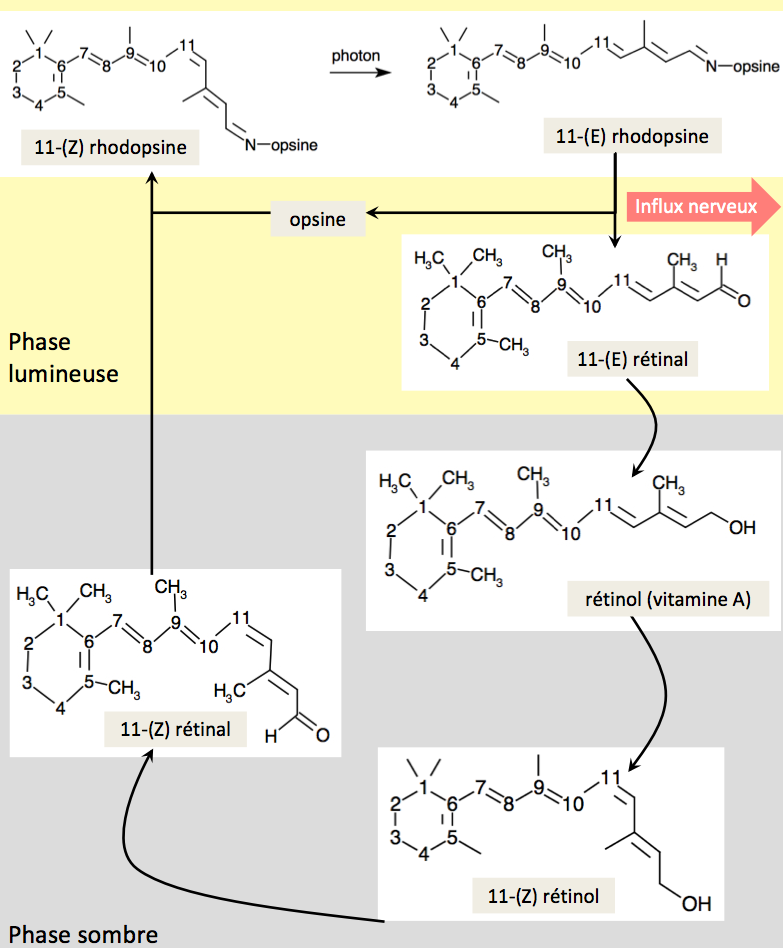
Les réactions dans le cadre « phase lumineuse » ont lieu dans les cellules photosensibles de la rétine, notamment les bâtonnets. Au niveau des cônes (vison des couleurs), il y a quelques variantes mais l’idée est la même. Ces réactions liées à la vision sont très rapides. Mais, le temps nécessaire pour qu’elles se déroulent explique le phénomène de persistance rétinienne. Les autres sont localisées dans l'épithélium pigmentaire de la rétine, une zone plus en profondeur de la rétine.
Dans certaines conditions, on peut transformer un isomère Z/E en un autre. Par exemple, l’isomérisation photochimique consiste à exposer la molécule à des photons d’énergie suffisante. Ces derniers brisent temporairement la double liaison, ce qui autorise la rotation et peut former l’autre isomère. En travaux pratiques, l’irradiation UV du (E)-azobenzène forme du (Z)-azobenzène. Les deux sont séparables par chromatographie sur couche mince.
Le mécanisme de la vision utilise l’isomérisation photochimique d'une espèce chimique formée à partir de la Vitamine A, la rhodopsine. Au cours d’un processus cyclique, les photons lumineux incidents sont captés par les cellules photosensibles qui envoient alors des influx nerveux au cerveau, ce qui permet la vision.

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








