Utilisation des substances colorées
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
De manière générale, la longueur d’onde absorbée croît avec le nombre n de doubles liaisons du chromophore. Il y a ainsi un lien entre la structure de la molécule et la longueur d’onde absorbée (théorie de Witt). Mais, des auxochromes sont des groupements susceptibles de modifier la longueur d’onde absorbée d’un chromophore.
En leur absence, on a la correspondance suivante pour les hydrocarbures :
| Valeur de n | Longueur d’onde absorbée |
| < 8 | < 400 nm (UV) |
| 8 | 400 (Violet) |
| 9 | 425 (Indigo) |
| 10 | 450 (Bleu) |
| 11 | 490 (Cyan) |
Une gamme de longueurs d’onde dans le visible correspond à une couleur. Après, quand une molécule absorbe une couleur, la lumière colorée qui nous parvient correspond à sa couleur complémentaire. Pour rappel, deux couleurs sont complémentaires quand elles sont opposées sur une représentation comme celle-ci-dessous. Par exemple, la couleur complémentaire du vert est le magenta, la couleur complémentaire du jaune est le bleu.

Cette représentation est celle employée en synthèse soustractive, quand on manipule des substances colorées. Par exemple, mélanger un colorant cyan (souvent confondu avec le bleu) avec un colorant jaune donnera une coloration verte.
Il est d’usage d’opérer une séparation entre les colorants :
• Les pigments ne sont en général pas solubles (notamment dans l’eau). Afin de les fixer, on emploie des liants, comme dans la peinture à l’huile. Un pigment recouvre une surface, mais ne se mélange pas avec le matériau recouvert.
• Les teintures, au contraire, se mélangent facilement avec le support à teindre : il y a absorption par le support des molécules colorées.
Notons que la frontière entre ces deux types de substances colorées n’est pas toujours nette.
Cette molécule peut être extraite de l’indigotier, une plante. Mais, vue la demande, l’indigo est aussi synthétisée industriellement, par exemple par la méthode de Baeyer-Drewsen :

L’indigo n’est pas soluble dans l’eau. Une difficulté est de fixer la couleur sur le tissu à traiter. Pour résoudre ce problème, l’indigo est transformé en une forme dit « leuco ». Cette forme est blanche, d’où son nom de « blanc indigo ». Mais, par contre, elle se lie très facilement aux fibres d’un tissu. Ensuite, en laissant le tissu traité exposé à l’air, le dioxygène va oxyder la forme leuco pour redonner la forme indigo souhaitée.

Comme celle-ci se trouve désormais au sein des fibres du vêtement, l’indigo reste fixé au tissu. La non-solubilité de l’indigo dans l’eau fait que la coloration résiste au lavage, ce qui est le but recherché !
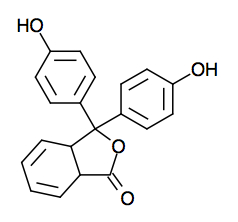
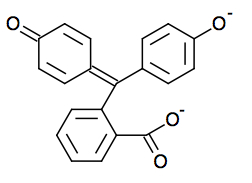
C'est le cas de la phénolphtaléine :
|
|
| Forme acide | Forme basique |
| Incolore | Rose violacé |
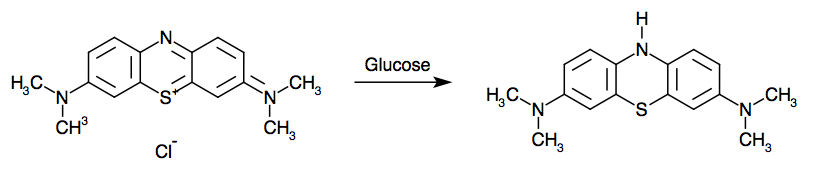
Une autre application intéressante des colorants en chimie est pour détecter la présence de certaines molécules. C’est par exemple le cas pour le bleu de méthylène, qui permet de tester la présence de glucose en solution, dans l’expérience de la bouteille bleue. Le glucose réduit la molécule du bleu de méthylène dont la forme réduite est incolore (la forme oxydée est bleue).
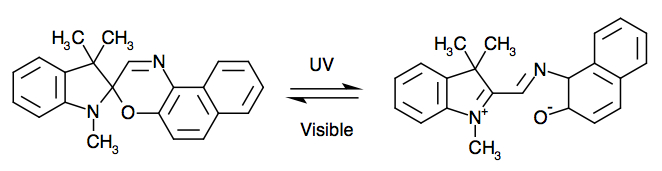
Comme application, il existe des verres de lunettes de vue qui ont la propriété de s’assombrir lorsqu’ils sont exposés à la lumière du Soleil, c'est-à-dire sous irradiation UV. Après, ils reprennent leur transparence ordinaire lorsque la luminosité diminue, autrement dit quand l’exposition UV cesse ou se réduit.
En nucléaire, les travailleurs portent des badges (dosimètre) qui permettent d’apprécier la dose de rayonnement reçue par une personne. Une autre application des molécules photochromes est par exemple des dosimètres à UV, pour les vacanciers s’exposant au Soleil.
Des recherches sont en cours, notamment avec l’oxyde de molybdène
Dans ce cadre là, on peut citer les peintures. Elles sont constituées de pigments liés par de l’huile (peinture à l’huile), de la gomme arabique (gouache) ou des polymères (peintures industrielles). Comme pigments, nous avons par exemple le dioxyde de titane
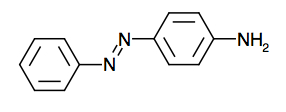
D’autre part, le para-aminoazobenzène est une molécule organique de couleur jaune, employée notamment pour les encres d’imprimantes, pour les fumigènes ou les laques. Elle a la structure suivante :
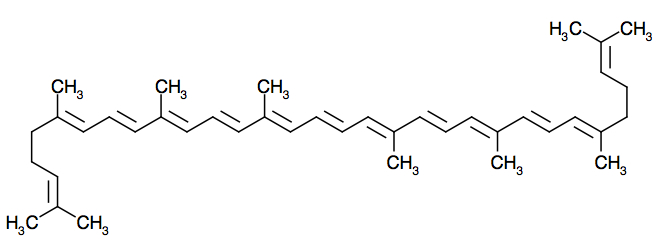
Par exemple, le lycopène est un colorant rouge, de code E160d. Cette molécule est présente naturellement dans la tomate, le pamplemousse, la pastèque. Elle est responsable de leur coloration rouge.
Il existe d’autres colorants d’origine naturelle, comme le bêta-carotène E160a (orange), la curcumine E100 (jaune).
D’autres sont artificiels. Ils sont dans l’ensemble plus stables, moins couteux, et n’ont quelquefois pas d’équivalent naturel.
On a par exemple le bleu patenté V, de code E131.
Le choix d’un colorant alimentaire se fait évidemment en fonction de la couleur recherchée, éventuellement par mélange (synthèse soustractive). Mais, l’effet sur l’organisme est aussi à étudier. Si certains colorants sont sans action biologique, d’autres peuvent se révéler bénéfiques (bêta-carotène). Mais il existe aussi des colorants reconnus comme nocifs ou potentiellement allergisants (comme le rouge cochenille E124).
Les colorants sont employés dans des domaines très variés. Dans certaines applications, on peut chercher des colorants qui changent de couleur :
• Par réaction chimique afin de modifier provisoirement les propriétés de la molécule (indigo des blue-jeans), ou pour signaler la présence d’une molécule (test au bleu de méthylène).
• Selon l’acidité d’une solution : indicateurs colorés et papier pH.
• Selon l’exposition à certains longueurs d’onde : molécules photochromes.
Dans d’autres applications, on peut par contre rechercher des colorants stables. Cela concerne les peintures, les laques, les vernis, les encres. On a également les colorants alimentaires. Dans ce cas là, l’effet potentiel des colorants sur l’organisme est à prendre en compte.

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








