Rendement d'une synthèse
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
Quel est le mode opératoire à suivre pour réaliser une synthèse ?
Qu’appelle-t-on rendement d’une synthèse ?
Quels sont les facteurs dont dépend le rendement d'une synthèse ?
- d’un ballon contenant le mélange réactionnel et de la pierre ponce
- d’un chauffe-ballon
- d’un réfrigérant à eau
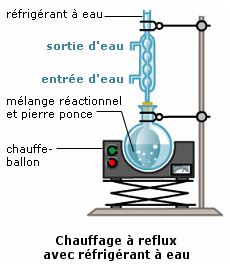
Attention : La réalisation du montage nécessite le port de gants et lunettes. Dans le cas où les espèces chimiques sont inflammables, il faut éviter toute flamme ou étincelle.
La circulation d’eau froide dans le réfrigérant à eau permet aux vapeurs formées de se liquéfier au contact des parois froides : il n’y a pas de vapeurs nocives qui s’échappent du montage et les espèces chimiques ne s’échappent pas du mélange.
La pierre ponce permet de réguler l’ébullition en créant des petites bulles dans le mélange.
On effectue la synthèse en milieu basique, ainsi, l'acide benzoïque est obtenu sous sa forme basique, l'ion benzoate de formule C6H5CO2-, très soluble dans l’eau.
Les ions permanganate en milieu basique sont réduits en dioxyde de manganèse, solide marron de formule MnO2.
Les couples rédox mis en présence sont :
MnO4- / MnO2 et C6H5CO2- / C6H5-CH2OH
L’équation de la réaction d’oxydation s’écrit :
3 C6H5CH2OH + 4 MnO4- → 3 C6H5CO2- + 4 H2O + 4 MnO2 + OH-
- du carbonate de sodium (pour rendre le milieu basique),
- du permanganate de potassium solide
- de l’eau distillée,
- de l’alcool benzylique
- quelques grains de pierre ponce.
• Après environ 30 minutes de chauffage, on filtre le mélange sur papier Büchner.
Le filtrat contient les ions benzoate.
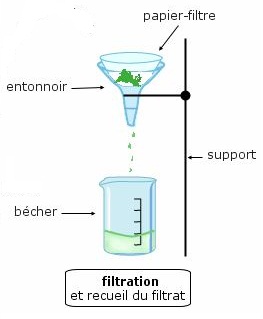
• Sous la hotte, acidifier le filtrat récupéré en ajoutant progressivement, par petites quantités et en agitant, de l’acide chlorhydrique concentré. L’addition d’acide provoque un dégagement gazeux de CO2 puis la précipitation de l’acide benzoïque.
• Filtrer la solution puis la laver avec de l’eau glacée.
• Placer le précipité dans un verre de montre, préalablement pesé vide .
• Porter le tout dans l’étuve (à 70 °C) pour éliminer les traces d’eau.
• Mesurer la masse du produit sec obtenu.
C’est un nombre compris entre 0 et 1, sans unité.
On écrit :
Le rendement peut s’exprimer en pourcentage.
La valeur du rendement dépend de plusieurs facteurs :
- la réaction n’est pas totale : une partie des réactifs n’est pas transformée.
- les pertes au cours des diverses étapes (lavage, séchage, recristallisation, vapeurs échappées au cours du reflux, etc…)
- erreur de pesée (mauvais séchage, oubli de faire la tare, etc…)
- réactions parasites lors de l'expérience.
Le rendement de la synthèse se calcule en faisant le rapport entre la masse de produit obtenue et la masse de produit que l’on devrait obtenir théoriquement.
Le rendement est un nombre inférieur à 1, qui dépend des conditions de manipulation et de la réaction.

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








