Dosage de solutions colorées par étalonnage
- Fiche de cours
-
Quiz et exercices
1
- Vidéos et podcasts
Quelle grandeur physique est liée à la couleur d’une solution ?
Qu’est-ce que la loi de Beer-Lambert ?
Quel est le principe d’un dosage par étalonnage ?
L’absorbance d’une solution se mesure à l’aide d’un spectrophotomètre.
Un détecteur mesure le flux lumineux en sortie. L’absorbance est directement affichée sur un écran du spectrophotomètre.
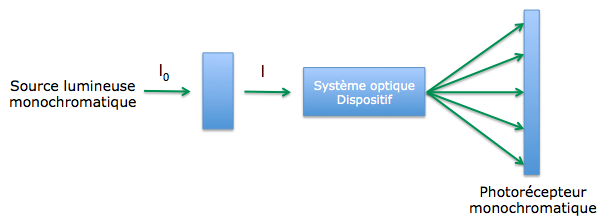
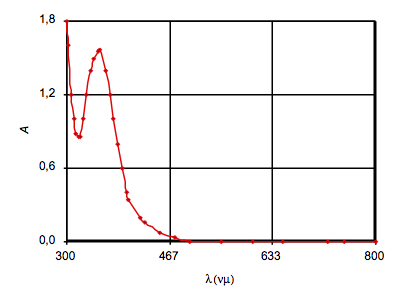
L’absorbance dépend de la longueur d’onde de la lumière.
Le maximum d’absorption du diiode se situe autour de λ = 350 nm, ce qui explique la coloration jaune brun de la solution (absorption dans l’ultraviolet).
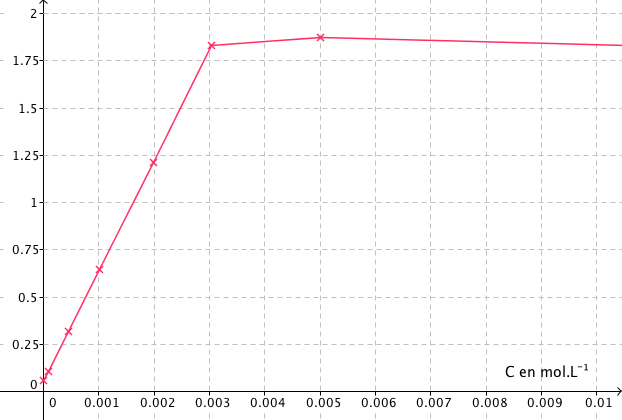
L’absorbance de la solution est proportionnelle à la concentration en diiode jusqu’à une valeur limite de l’ordre de 10-1 mol.L-1.
L’absorbance A est donc proportionnelle à la concentration C et à l’épaisseur l de la cuve.
La relation entre l’absorbance A et la concentration C en espèce colorée est :
l : épaisseur de la cuve en cm
C : concentration molaire en espèce colorée en mol.L-1
Pour cela, on réalise des solutions diluées à partir de S, et on compare la couleur de la solution S’ avec la couleur des autres solutions.
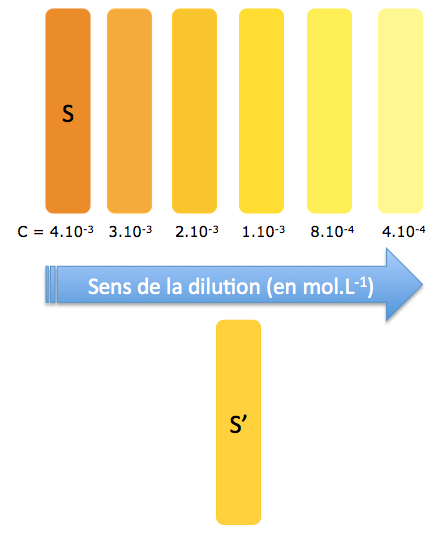
Dans cet exemple, on peut encadrer C' de la manière suivante : 1.10-3 mol.L-1 < C' < 2.10-3 mol.L-1.
On choisit une longueur d’onde de travail adaptée, pour cela, on réalise une courbe A = f(l).
Pour une longueur d’onde fixée, on réalise une courbe d’étalonnage. Pour cela, on mesure et on note l’absorbance de chaque solution diluée. On trace la courbe d'absorbance en fonction de la concentration.
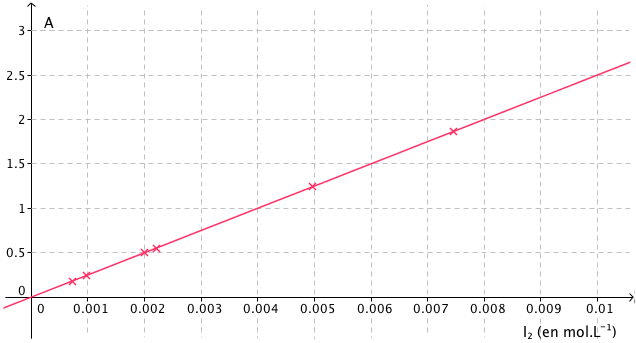
La courbe est une droite passant par l’origine du repère.
Si la concentration C’ est trop élevée, on réalise une dilution de la solution S’.
On mesure l’absorbance A’ (ordonnée) de la solution S’ et on reporte sa valeur sur la courbe d’étalonnage. L’abscisse du point est la concentration C’.
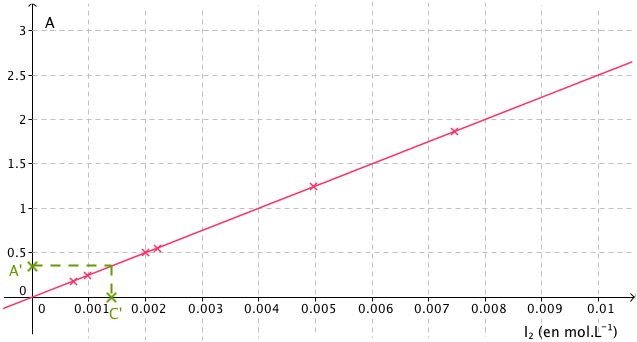
On détermine ainsi la valeur de la concentration C’ par intrapolation.
L’absorbance A est une grandeur qui mesure l’absorption de la lumière par une solution colorée.
L’absorbance dépend de la concentration de la solution et de la longueur d’onde de la lumière qui traverse la solution.
La loi de Beer-Lambert donne la relation entre l’absorbance A et la concentration C : A = ε l C.
Pour déterminer la concentration d’une solution inconnue, on peut réaliser une échelle de teinte ou réaliser une courbe d’étalonnage.
Teste dès maintenant tes nouvelles connaissances dans notre quiz
Vous avez obtenu75%de bonnes réponses !
Reçois l’intégralité des bonnes réponses ainsi que les rappels de cours associés

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








