Réaction d'oxydoréduction : méthodes générales et exemples
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
Un réducteur est une espèce chimique susceptible de perdre un ou plusieurs électrons, lors d’une réaction durant laquelle il s’oxyde. La demi-équation électronique d’une oxydation s’écrit :
Les espèces chimiques intervenant dans un demi-réaction constituent un couple rédox, qui se note
Une réaction d’oxydoréduction se caractérise par un transfert d’électron(s) d’un réducteur d’un couple rédox vers un oxydant d’un autre couple.
Une espèce chimique qui intervient dans un couple en tant que réducteur et comme oxydant dans un autre couple est un ampholyte. L’adjectif correspondant est amphotère. Par exemple, le peroxyde d’hydrogène (eau oxygénée)
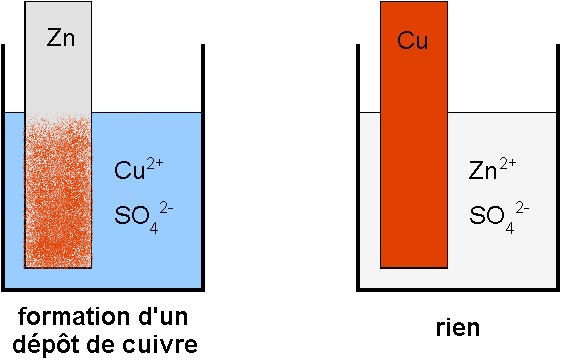
La partie immergée de la lame de zinc se recouvre progressivement d’un dépôt rouge de cuivre. On a :
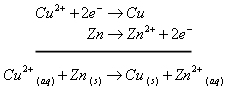
Rien ne se passe au niveau de la lame de cuivre. La réaction
D’une manière générale, une réaction d’oxydoréduction se produisant sans apport d’énergie extérieur est dite réaction spontanée (« réaction naturelle »). Sa réaction inverse ne se produit pas, sauf avec un apport d’énergie. Nous verrons dans une prochaine fiche que la charge d’une batterie électrique engendre une réaction de ce type, nommée réaction forcée.
Plus rarement, il existe des couples rédox où l’oxydant et le réducteur sont deux ions différents d’un même métal. Par exemple, le couple ion ferrique/ion ferreux :
Par exemple, avec le couple ion tétrathionate / ion thiosulfate :
Dans ce cas, il n’y rien d’autre à faire. Des cas plus complexes seront vus au 3.d.
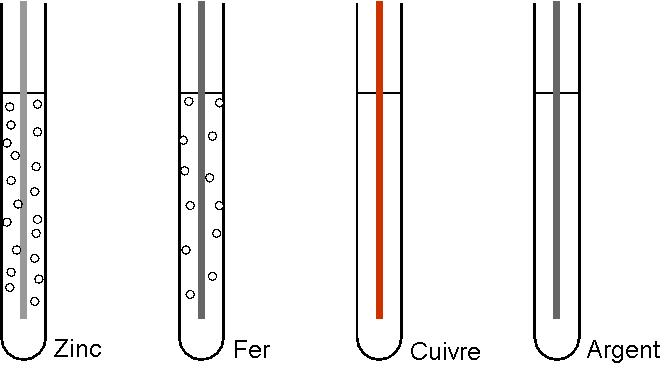
Par exemple avec le zinc, on écrit :
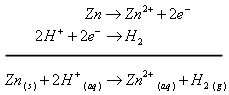
Mais rien avec le cuivre, l’argent, le platine, l’or.
Exemple détaillé : on considère le couple ion permanganate / ion manganèse
En première écriture, sans chercher à équilibrer :
Il manque 4 atomes O du côté droit, que l’on ajoute par des molécules d’eau :
Mais maintenant, il manque des 8 atomes H du côté gauche, on ajoute donc des
Pour terminer, on équilibre les charges électriques en trouvant n :
Par exemple, si on approche un ruban de magnésium d’une flamme (bec Bunsen), le métal va brûler en émettant une lumière blanche intense. Une fois la réaction terminée, le ruban présente une couleur blanche. Le magnésium est oxydé par le dioxygène de l’air, que nous écrivons symboliquement comme :
Du côté du dioxygène, celui-ci se réduit. Nous l’écrivons provisoirement comme :
En fait, en voie sèche, les ions ne seront pas libérés, mais vont s’associer pour former de l’oxyde de magnésium
Autre exemple, la rouille (oxydation du fer) est une réaction d’oxydoréduction lente :
Le produit formé est de l’oxyde de fer III, la forme la plus courante de la rouille. Cette réaction ne peut pas se produire sans la présence d’eau. C’est ainsi un cas intermédiaire entre les réactions en phase aqueuse et par voie sèche.
Parmi les couples rédox importants à connaître, on a notamment ceux formés à partir d’éléments chimiques métalliques. On a aussi le couple
Les réactions d’oxydoréductions étudiées ont lieu le plus souvent en phase aqueuse, mais il en existe des réactions d’oxydoréduction par voie sèche, dont les combustions. D’autres réactions sont moins spectaculaires et plus lentes, comme l’oxydation du fer (rouille).
Par exemple, le platine catalyse la réaction du peroxyde d’hydrogène sur lui-même (dismutation)
Aussi, les pots catalytiques de véhicules interviennent de la même manière pour faire réagir certains polluants émis par les moteurs, comme le monoxyde de carbone CO et le monoxyde d’azote NO, afin de produire du dioxyde de carbone et du diazote.

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








