Fonctionnement d'une pile
- Fiche de cours
- Quiz et exercices
- Vidéos et podcasts
On remplit un tube en U avec une solution de nitrate d’ammonium
On relie électriquement les électrodes à une petite lampe électrique. La lampe s’allume : on vient de fabriquer une pile électrique, la pile Daniell.
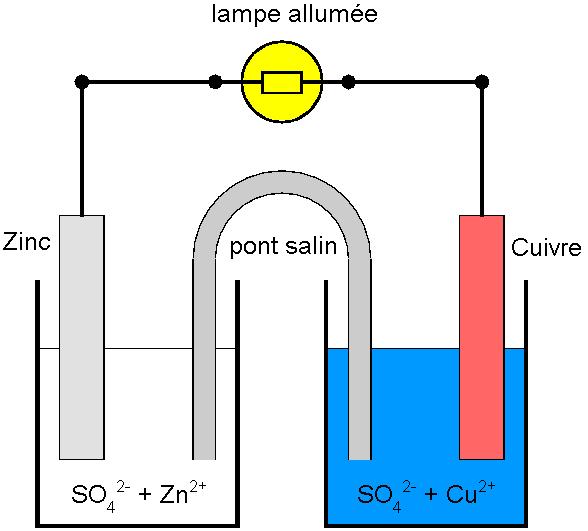
Pour trouver expérimentalement les polarités de la pile, on branche un voltmètre à ses bornes. Si celui-ci indique une valeur négative, alors on l’a branché à l’envers. Avec un branchement correct, la borne « com » (négative) du voltmètre est reliée à l’électrode de zinc. La borne positive est l’électrode de cuivre.
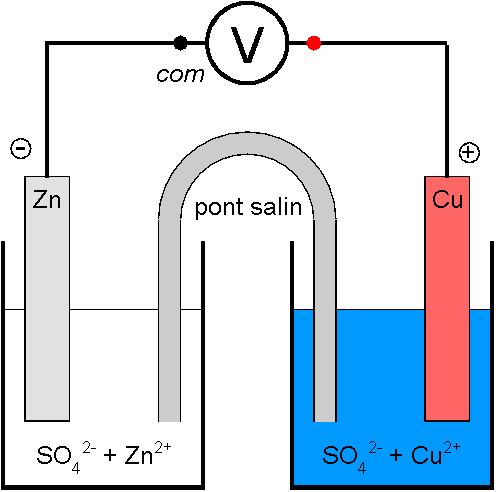
Dans un montage électrochimique, l’électrode où se produit une réduction est la cathode.
Un réducteur est une espèce chimique susceptible de céder un ou plusieurs électron(s) lors d’une oxydation :
Une électrode où se produit une oxydation est une anode.
Dans les deux demi-équations électroniques, l’oxydant et le réducteur forment un couple, qui se note
• Au niveau de l’électrode de cuivre, il y a réduction des ions cuivre
Le cuivre formé se dépose sur l’électrode, qui grossit durant le fonctionnement de la pile. Comme la réaction est une réduction, l’électrode de cuivre est la cathode.
La réaction capte des électrons. L’électrode de cuivre attire les électrons, qui ne peuvent venir que du circuit électrique. L’électrode de cuivre est la borne positive de la pile.
• Au niveau de l’électrode de zinc, il y a oxydation de celui-ci, selon la demi-équation électronique :
L’électrode de zinc est progressivement consommée. Comme il s’agit d’une réaction d’oxydation, l’électrode de zinc est l’anode.
La demi-équation électronique libère des électrons dans le circuit électrique. L’électrode de zinc est la borne négative.
Remarque : associer les termes anode/cathode aux polarités est une mauvaise idée, car dans le cadre d’une électrolyse, les relations anode/cathode et polarités sont inversées !
• Globalement, l’équation d’oxydoréduction qui lieu au sein de la pile est trouvée en « sommant » les deux demi-équations électroniques :
Cette réaction est la réaction spontanée qui a lieu entre les ions cuivre et le zinc. Elle libère de l’énergie. C’est l’énergie chimique liée à cette réaction qui est exploitée par la pile et récupérée en partie sous la forme d’énergie électrique.
La réaction inverse (cuivre réagissant avec les ions zinc) est possible, mais est elle est consommatrice d’énergie. Elle n’a pas donc lieu dans la pile.
• Sans le pont salin, la pile ne fonctionnerait pas, car il assure l’électroneutralité de chaque demi-pile, via la migration de ses ions. Durant le fonctionnement de la pile, la solution de sulfate de zinc s’enrichit en ions zinc ; les ions nitrate
On peut ainsi lire que les couples rédox de la pile sont
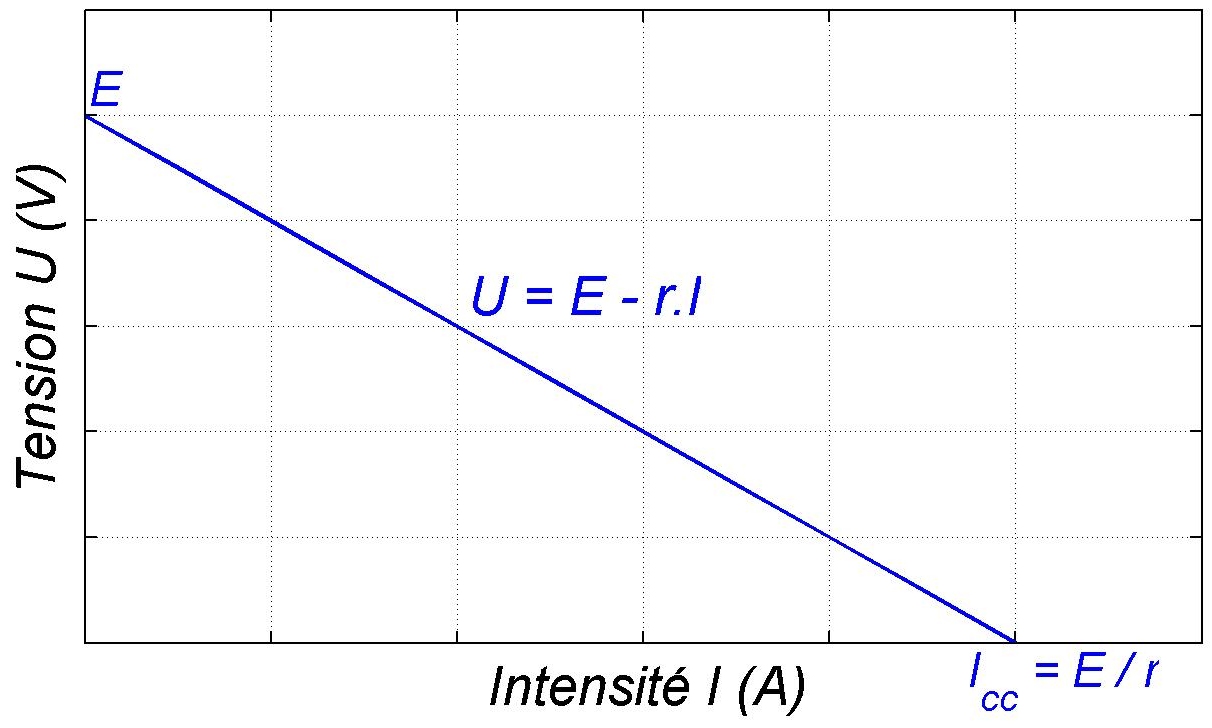
E est la force électromotrice. Cette tension est liée aux couples rédox employés dans la pile. Elle dépend aussi des concentrations des ions et de la température. Pour une pile Daniell avec
r est la résistance interne de la pile (en Ohm). Elle est liée à la mobilité des ions, notamment au niveau du pont salin. En travaux pratiques, les valeurs sont de l’ordre de centaines d’Ohms, ou même de
En traçant l’évolution de la tension U fonction de l’intensité I, on voit que la tension décroît jusqu’à s’annuler lorsque l’intensité vaut une valeur dite d’intensité de court-circuit
où I (en Ampère) est l’intensité, supposée constante, du courant électrique. Q est reliée à la quantité d’électrons
La capacité d’une pile est la charge électrique totale
A l’anode, il se produit une oxydation. A la cathode, une réduction. La réaction d’oxydation libère des électrons dans le circuit électrique au niveau de la borne –, la réaction de réduction capte des électrons à la borne +.
La charge électrique Q qui a transité dans un circuit électrique pendant une durée
La capacité

Des quiz et exercices pour mieux assimiler sa leçon
La plateforme de soutien scolaire en ligne myMaxicours propose des quiz et exercices en accompagnement de chaque fiche de cours. Les exercices permettent de vérifier si la leçon est bien comprise ou s’il reste encore des notions à revoir.

Des exercices variés pour ne pas s’ennuyer
Les exercices se déclinent sous toutes leurs formes sur myMaxicours ! Selon la matière et la classe étudiées, retrouvez des dictées, des mots à relier ou encore des phrases à compléter, mais aussi des textes à trous et bien d’autres formats !
Dans les classes de primaire, l’accent est mis sur des exercices illustrés très ludiques pour motiver les plus jeunes.

Des quiz pour une évaluation en direct
Les quiz et exercices permettent d’avoir un retour immédiat sur la bonne compréhension du cours. Une fois toutes les réponses communiquées, le résultat s’affiche à l’écran et permet à l’élève de se situer immédiatement.
myMaxicours offre des solutions efficaces de révision grâce aux fiches de cours et aux exercices associés. L’élève se rassure pour le prochain examen en testant ses connaissances au préalable.

Des vidéos et des podcasts pour apprendre différemment
Certains élèves ont une mémoire visuelle quand d’autres ont plutôt une mémoire auditive. myMaxicours s’adapte à tous les enfants et adolescents pour leur proposer un apprentissage serein et efficace.
Découvrez de nombreuses vidéos et podcasts en complément des fiches de cours et des exercices pour une année scolaire au top !

Des podcasts pour les révisions
La plateforme de soutien scolaire en ligne myMaxicours propose des podcasts de révision pour toutes les classes à examen : troisième, première et terminale.
Les ados peuvent écouter les différents cours afin de mieux les mémoriser en préparation de leurs examens. Des fiches de cours de différentes matières sont disponibles en podcasts ainsi qu’une préparation au grand oral avec de nombreux conseils pratiques.

Des vidéos de cours pour comprendre en image
Des vidéos de cours illustrent les notions principales à retenir et complètent les fiches de cours. De quoi réviser sa prochaine évaluation ou son prochain examen en toute confiance !








